Mostrando artículos por etiqueta: aprobación
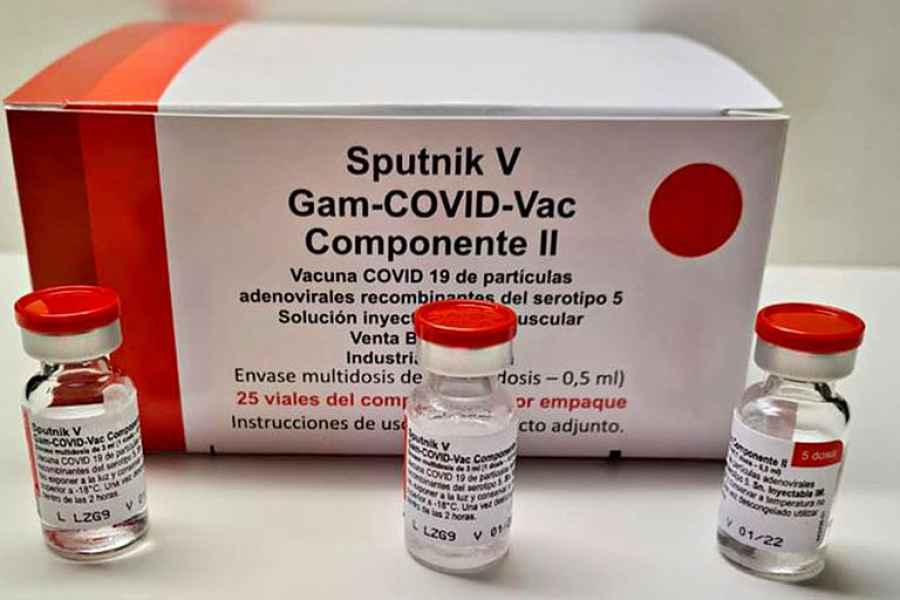
Anmat aprobó la Sputnik V nacional producida por Richmond
Laboratorios Richmond, empresa farmacéutica regional con base en Argentina, recibió en la tarde de ayer la aprobación por parte de la ANMAT de la vacuna Sputnik V (Componente I y Componente II), cuyo proceso de
elaboración final se realiza en Argentina.
Esta aprobación permitirá concretar la producción y comercialización de la vacuna, facilitando así el inicio de los trámites de registro ante las autoridades de regulación sanitaria de otros países de la región latinoamericana.
De esta forma, finaliza una etapa de obtención de certificaciones regulatorias que culminará, en los próximos meses, con la inauguración de una nueva planta modelo de biotecnología para la elaboración de vacunas más modernas y con tecnología de avanzada, pionera en el país. Actualmente, esta planta se encuentra en construcción dentro del predio de la empresa en el Parque Industrial de Pilar y dispondrá de una capacidad de producción máxima anual
de 500 millones de vacunas para COVID y otras enfermedades.
Asimismo, se destaca la tarea profesional de excelencia llevada a cabo por ANMAT en plena pandemia del COVID 19, ejerciendo con profesionalidad sus capacidades de fiscalización y regulación, y estableciendo exigencias que mejoraron la concreción del proyecto de elaboración en el país de la vacuna Sputnik V (Componentes I y II).
La píldora de Pfizer contra el Covid-19 fue aprobada en Europa
La Agencia Europea de Medicamentos (EMA) aprobó la píldora anticovid del laboratorio Pfizer, que se convierte en el primer tratamiento oral contra el covid-19 autorizado en la Unión Europea (UE).
“El Comité de Medicamentos de Uso Humano (CHMP) de la EMA ha recomendado la concesión de una autorización condicional de comercialización para el medicamento antiviral oral Paxlovid”, declaró el regulador europeo en un comunicado.
La EMA “recomendó autorizar el Paxlovid para el tratamiento del covid-19 en los adultos que no necesitan asistencia respiratoria pero que presentan un riesgo de que la enfermedad se agrave”.
Los antivirales actúan reduciendo la capacidad de un virus para replicarse, frenando así la enfermedad.
Son muy esperados porque son fáciles de administrar, pudiendo ser simplemente ingeridos con un vaso de agua.
Pfizer había declarado en diciembre que su píldora anticovid reducía en casi 90% las hospitalizaciones y muertes en personas de riesgo cuando era ingerida en los primeros días después de la aparición de los síntomas.
La EMA evaluó los datos de un estudio en el que participaron pacientes con covid-19 que demostraron que “el tratamiento con Paxlovid redujo significativamente las hospitalizaciones o muertes en pacientes que presentaban al menos una enfermedad subyacente que los exponía a un riesgo de contraer un covid-19 grave”.
La mayoría de los pacientes del estudio estaban infectados con la variante Delta, indicó la Agencia Europea de Medicamentos, pero señaló que según las pruebas de laboratorio, Paxlovid debería seguir siendo eficaz contra Ómicron.
La píldora Pfizer es una combinación de una nueva molécula, PF-07321332, y ritonavir, un antiviral contra el VIH, que se toman en forma de comprimidos separados.
“El Comité de Medicamentos de Uso Humano de la EMA concluyó que los beneficios del medicamento son mayores que sus riesgos para el uso aprobado y enviará sus recomendaciones a la Comisión Europea (CE) para una decisión rápida, aplicable en todos los Estados miembros de la UE”.
Este procedimiento de aprobación por parte de la CE suele llevar algunas horas o días.
“Con la autorización de Paxlovid esta semana, se han autorizado 6 medicamentos anticoronavirus en el marco de la estrategia terapéutica de la UE”, dijo en otro comunicado la comisaria europea de Salud y Seguridad Alimentaria, Stella Kyriakides.
Estados Unidos, Canadá e Israel forman parte de un puñado de países que ya han dado luz verde al tratamiento de Pfizer.
Aprueban en Argentina una nueva medicación para el asma grave
En Argentina, el asma afecta a más del 12% de los niños y adolescentes y a cerca del 6% de la población entre 20 y 44 años. Causa por año más de 400 muertes y 15 mil internaciones en hospitales públicos de todo el país.
Es que alrededor de un 20% de los pacientes presenta una variante moderada a severa de la enfermedad y no logra un buen control, lo que suele evidenciarse con síntomas persistentes y exacerbaciones recurrentes. Las exacerbaciones son episodios agudos y angustiantes, caracterizados por falta de aire, sensación de opresión en el pecho y tos, que pueden terminar en una internación. Los pacientes graves o severos son aquellos en los que el asma persiste pese a utilizar altas dosis de la terapia habitual (corticoides inhalados en dosis máximas, sumado a uno o más broncodilatadores de larga duración).
Para este grupo de pacientes con un asma de semejante intensidad, existe una nueva opción terapéutica disponible en nuestro país, ya que la ANMAT aprobó el uso de la droga dupilumab en adultos y adolescentes a partir de 12 años de edad.
Según la aprobación, sirve como tratamiento de mantenimiento complementario para el asma severa con inflamación de tipo 2 caracterizada por eosinófilos en sangre elevados y/o FeNO elevado, que no se controlan adecuadamente con dosis altas de corticosteroides inhalados, más otro medicamento para tratamiento de mantenimiento. Dupilumab es un anticuerpo monoclonal de origen completamente humano que ha demostrado su capacidad de reducir significativamente las exacerbaciones por asma, mejorar la función pulmonar y la calidad de vida de los pacientes.
“Esta nueva medicación está indicada para los pacientes con asma grave, que presentan una historia de exacerbaciones, hospitalizaciones de urgencia y una función pulmonar disminuida, que usan demasiados corticoides por vía oral o inyectable y tienen una pésima calidad de vida. Su asma les impide o dificulta hacer ejercicio, caminar rápido, subir escaleras o dormir de corrido. Contamos con un tratamiento muy esperanzador, lo que representa una excelente noticia para estos pacientes y sus médicos”, sostuvo el doctor Daniel Colodenco, médico neumonólogo, Director de la Carrera de Especialistas en Neumonología de la UBA y ex Jefe de Alergia e Inmunología del Hospital ‘María Ferrer’.
“Los casos graves no son necesariamente infrecuentes, sino que, en ocasiones, algunos pacientes tienden a subestimar la severidad de la enfermedad o tal vez sea resignación: luego de años de convivir con determinados síntomas, los incorporaron como parte de su vida, pero no hay por qué conformarse con una vida limitada por el asma”, agregó la doctora Ana María Stok, neumonóloga, Directora Médica de Investigaciones en Patologías Respiratorias y Coordinadora General del Grupo Asma NOA.
Respecto de los objetivos terapéuticos en el asma grave, Stok describió que “ningún paciente es igual a otro, pero para estos cuadros graves, por lo general, se busca reducir los episodios de exacerbaciones severas, que preocupan mucho a los pacientes. Otro objetivo es mejorar la función pulmonar para recuperar calidad de vida: no tener que ausentarse a la escuela o al trabajo, ni dejar que tu asma te aísle de todo. Además, para quienes usan corticoides orales, tanto en forma diaria como en ciclos cortos, procuramos ir reduciendo de a poco su uso y, si es posible, hacerlo por completo”.
“Este último punto es particularmente relevante porque sabemos que más de dos cursos anuales de corticoides aumentan la posibilidad de contraer o agravar cuadros como diabetes, síndrome metabólico, osteoporosis, hipertensión arterial, obesidad, depresión y cataratas, entre otras afecciones”, completó Colodenco.
Mejor control del asma grave con dupilumab
En el estudio clínico LIBERTY ASTHMA QUEST, que incluyó 1902 pacientes mayores de 12 años, el uso de dupilumab redujo un 47,7% más que el placebo la tasa anual de exacerbaciones severas y mejoró al doble la función pulmonar, promoviendo un mejor control del asma.
Respecto del uso de corticoides orales, en el estudio VENTURE, que incluyó 210 pacientes, el 70.1% de quienes recibieron dupilumab logró reducir su dosis (contra 41.9% en el grupo control). El 80% de los que recibieron la droga y redujeron la dosis de corticoides, lo hizo al menos a la mitad (contra un 50%); el 69% del primer grupo pudo llevarla a menos de 5 mg/día (contra 33%) y el 48% pudo dejar los corticoides orales por completo (contra el 25% en el otro grupo). En total, la tasa de exacerbaciones severas fue un 59% menor en quienes recibieron dupilumab y mejoraron más la función pulmonar.
Además, el estudio abierto de extensión denominado TRAVERSE siguió a largo plazo a los participantes de los dos estudios antes mencionados y mostró que todos los resultados se sostuvieron en el tiempo durante 96 semanas más luego de finalizadas esas investigaciones. Entre el 50% y el 70% de los casos de asma se originan por una respuesta hiperactiva de un mecanismo inflamatorio denominado ‘inflamación de tipo 2’ lo que aumenta la secreción mucosa, obstruye las vías aéreas y genera hiperreactividad bronquial, procesos que generan las manifestaciones que afectan la vida cotidiana del paciente.
Gran parte de este mecanismo se explica por un aumento de la actividad de proteínas conocidas como interleuquinas 4 y 13, que son responsables de la limitación que la enfermedad severa les impone a los pacientes. Stok puntualizó que “los estudios clínicos incluyeron pacientes con asma grave en general, pero los resultados de eficacia fueron consistentemente superiores en los pacientes en los que se podía identificar la presencia de biomarcadores asociados con inflamación de tipo 2”.
“Este mismo proceso inflamatorio se da en otras enfermedades como la dermatitis atópica, la poliposis nasal y determinadas alergias alimentarias. De hecho, es habitual que una persona con asma presente simultáneamente alguna de esas comorbilidades. La primera aprobación que obtuvo dupilumab en nuestro país fue en 2020, en dermatitis atópica severa, y está siendo investigado para otros cuadros mediados por mecanismos inmunológicos afines”, concluyó Colodenco.
Autorizan el autocultivo de cannabis y la venta de cremas y aceites medicinales
El decreto 883/2020 tiene características históricas. Es que, por primera vez, se autoriza en el país el autocultivo de cannabis y el Estado nacional se pone a la cabeza para nutrir a entidades públicas de recursos e insumos que faciliten la investigación en entidades públicas.
La normativa publicada en el Boletín Oficial apunta a la modificación central del artículo 8 de la ley 27.350, que hace tres años autorizó el uso para fines medicinales aunque con grandes falencias. Por caso, lo restringía sólo al uso para la epilepsia refractaria.
Ahora, el Gobierno pone en marcha la regulación del cultivo doméstico, como así también la venta de aceites y cremas medicinales en farmacias, y apunta a "poner operativo" el Programa Nacional de Cannabis (REPROCANN), que consiste en un registro de pacientes que tienen indicada la utilización de productores derivados de la planta.
De hecho el texto publicado hoy apunta a las restricciones de la ley vigente: “Tenía restricciones reglamentarias que configuraron barreras al acceso oportuno del Cannabis por parte de la población". Por lo tanto, se aduce, "un núcleo significativo de usuarias y usuarios han decidido satisfacer su propia demanda de aceite de Cannabis a través de las prácticas de autocultivo".
Se reconoce en los últimos tiempos el surgimiento y la multiplicación de "organizaciones civiles que actualmente gozan no solo de reconocimiento jurídico sino también de legitimación social”.
Desde ahora, entidades cannábicas podrán producir. Pero también se asume que el Ministerio de Salud iniciará una carrera para "garantizar los insumos necesarios para facilitar la investigación médica y/o científica de la planta de cannabis".
También se habilitan investigaciones y cultivos en universidades, siempre con fines terapéuticos. Se pondrá el ojo en "la eficiencia en el uso de los recursos, a la producción regional y aquella realizada a través de los laboratorios públicos nucleados en la Agencia Nacional de Laboratorios Públicos (ANLAP)".
No es menor que desde ahora en adelante, todo tipo de pacientes con diferentes patologías y según indicación médica, podrán acceder a los productos en el marco de "un tratamiento medicinal, terapéutico y/o paliativo del dolor" habiendo dado su consentimiento.
La promesa, en tal sentido, es que el Gobierno garantizará la provisión gratuita para quienes no tengan acceso.
Las personas que lo requieran podrán solicitar la autorización "de cultivo para sí, a través de un o una familiar, una tercera persona o una organización civil autorizada".
La norma también deja abierta la apertura de regulaciones de las administraciones provinciales. Días atrás, ANMAT ya había autorizado la comercialización de un producto que contiene cannabidol, el componente terapéutico de la planta.
Cáncer de mama en hombres
Palbociclib, una droga de última generación para el tratamiento de un subtipo de cáncer de mama llamado ‘Luminal’, recibió la aprobación de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) para su uso en hombres con cáncer de mama avanzado o metastásico con receptor de estrógeno (RE) positivo, receptor 2 del factor de crecimiento epidérmico humano (HER2) negativo, en combinación con terapia endócrina. Es la primera terapia de su clase (inhibidores de las CDK 4/6) en recibir aprobación para el tratamiento en varones. Además, Argentina es el primer país en Latinoamérica y el sexto en el mundo en aprobar esta nueva indicación.
La Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés) ya había aprobado esta nueva indicación en 2019 a la luz de la información registrada de la práctica clínica diaria ‘del mundo real’ de este tipo de evidencia.
“Si bien la incidencia de cáncer de mama es muy inferior en los varones, también es cierto que disponemos de limitadas alternativas de tratamiento basadas en la evidencia para estos pacientes, es decir, falta de ensayos clínicos, ante lo cual las terapéuticas se extrapolan a las de cáncer de mama femenino, por lo que esta nueva indicación de palbociclib es una muy buena noticia. Además, el hecho de que se haya aprobado gracias a evidencia del mundo real muestra un abordaje innovador y, sin dudas, evidencia una amplitud de criterio para tomar decisiones que hacen a la salud y a la calidad de vida de quienes atraviesan por enfermedades de este tipo” explicó la Dra. Valeria Cáceres, médica oncóloga clínica, Jefa del Departamento de Oncología Clínica del Instituto ‘Ángel Roffo’ (UBA), y Directora de la Carrera de Especialistas en Oncología de la Facultad de Medicina de la Universidad de Buenos Aires.
En nuestro país, se diagnostican por año más de 21 mil casos nuevos de cáncer de mama. Si bien suele considerarse al cáncer de mama solo como una enfermedad exclusiva de la mujer (una de cada ocho desarrollará esta enfermedad en algún momento de su vida) también afecta a varones: de cada 100 cánceres de mama en mujeres se da uno en los varones.
Palbociclib está aprobado en nuestro país desde principios de 2016 y representó un antes y un después en el tratamiento de este tipo de Tumor de Mama (Luminal), contribuyendo a prolongar la sobrevida libre de progresión en más de 27 meses en promedio y un retraso en el inicio de quimioterapia en más de 40 meses en mujeres postmenopáusicas con el subtipo receptor de estrógeno (RE) positivo, HER2 negativo metastásico en combinación con terapia endócrina. Esto representó en su momento el primer avance significativo en terapias de primera línea en los últimos 10 años.
Asimismo, palbociclib cuenta con otra indicación que se realiza en segunda línea: para pacientes con este subtipo de tumor que tengan progresión de la enfermedad tras haberse sometido a terapia endócrina. “Claramente, es una alternativa terapéutica útil para los pacientes con cáncer de mama avanzado. Ha demostrado múltiples beneficios y, a lo largo de estos años, podemos afirmar que ha mejorado la calidad de vida de muchos pacientes. El hecho de que ahora tenga una indicación en varones amplía las oportunidades, representa una muy buena noticia y un verdadero avance”, describió el Dr. Enrique Díaz Cantón, médico oncólogo clínico, Profesor Asociado de Medicina I y II y Profesor Titular de Inteligencia Artificial en Medicina, en el Instituto Universitario CEMIC (IUC).
“Pese a que la difusión sobre la prevención, la concientización acerca de la enfermedad, la disponibilidad de alternativas terapéuticas y la cantidad y formación de los profesionales de salud involucrados en la atención de estas patologías, son factores que contribuyen a que más pacientes consulten a tiempo y puedan acceder a un mejor pronóstico, lamentablemente todavía muchos llegan a la consulta con la enfermedad en estadios avanzados o experimentan recaídas”, afirmó la Dra. Cáceres.
“El diagnóstico a tiempo es indispensable para obtener un mejor pronóstico del cuadro. El autoexamen mamario es una práctica saludable y necesaria, pero la consulta periódica con el especialista y la realización de una ecografía mamaria /mamografía cuando el médico lo indique -teniendo en cuenta la edad y los antecedentes familiares de cada persona- son fundamentales para detectar la enfermedad de manera temprana y comenzar lo antes posible con el tratamiento. En el caso de los varones, si bien por lo general es una población en la que esta enfermedad generalmente no se sospecha, también es importante estar atentos a los antecedentes familiares y a cualquier cambio en el tórax, en la piel o que involucre a las mamas, así como también algún otro síntoma inusual y consultar con el médico de cabecera”, concluyó el Dr. Díaz Cantón.
Aprueban uso de diagnóstico 99% eficaz
La compañía Abbott ha anunciado que ha obtenido la marca CE según la Directiva IVD (98/79/EC), de su prueba serológica de laboratorio para detectar el anticuerpo IgG frente al nuevo coronavirus SARS-CoV-2. Este análisis de anticuerpos es un paso importante para conocer si una persona ha pasado la Covid-19 con anterioridad a la realización de la prueba. Además, estas pruebas aportarán un mayor conocimiento de la respuesta inmunitaria que se produce frente al nuevo coronavirus. Por ejemplo, se podrá conocer el tiempo que estos anticuerpos permanecen en el organismo y si ofrecen inmunidad a quienes lo hayan superado. Asimismo, conocer estos datos puede ser de utilidad para el desarrollo de tratamientos y vacunas.
Las pruebas moleculares detectan si un paciente tiene el virus activo, mientras que las pruebas de anticuerpos determinan si alguien ha estado infectado. Así, esta prueba de anticuerpos IgG frente al SARS-CoV-2 identifica el anticuerpo IgG, proteína que produce el organismo en las etapas tardías de la infección. Esta podría permanecer en el organismo durante meses y posiblemente años después de la recuperación del paciente.
La prueba ha demostrado una especificidad y sensibilidad de más del 99 por ciento a los 14 o más días después de comenzar los síntomas.
Mike Clayton, director gerente de la división de diagnóstico de Abbot para el norte de Europa, dijo: "Abbott se ha centrado en llevar las pruebas COVID-19 al mercado lo más rápido posible para ayudar a abordar esta pandemia". "Estamos orgullosos de poder proporcionar nuestras pruebas de anticuerpos de inmediato, ya que ayudarán a comprender quién ha tenido el virus, lo que nos dará una mayor confianza a medida que volvamos a vivir. Estamos colaborando con el NHS, organismos de salud pública y laboratorios privados en todo el Reino Unido para permitir que esta prueba se use allí". Abbott está aumentando significativamente su fabricación europea para pruebas de anticuerpos y también ha dicho que desarrollará pruebas para la detección del anticuerpo, IgM, en un futuro próximo para expandir el rango de posibles pruebas de anticuerpos.
La FDA aprueba una vacuna adyuvante para la influenza H5N1
La FDA aprobó una vacuna adyuvante monovalente contra la influenza (H5N1) (Audenz, Seqirus) para ayudar a proteger a las personas de 6 meses en adelante. Es la primera vacuna antigripal adyuvante basada en células diseñada para proteger contra el H5N1 en caso de una pandemia.
La nueva vacuna combina 2 tecnologías: El adyuvante MF59 y la fabricación de antígenos basados en células.
Las vacunas contra la influenza que usan el adyuvante MF59 pueden mejorar y ampliar la respuesta inmune del cuerpo al inducir anticuerpos contra las cepas de virus que han mutado. Este adyuvante es una parte importante de la planificación de la preparación para una pandemia porque reduce la cantidad de antígeno requerida para producir una respuesta inmune, permitiendo aumentar el número de dosis de vacuna que se desarrollan.
Fuente: Pharmacy Times / COFA
La FDA aprueba tratamiento para C Difficile en niños
La agencia regulatoria del medicamento de Estados Unidos (FDA) aprobó una Solicitud de Nuevo Medicamento para fidaxomicina (Dificid, Merck) para suspensión oral y una Solicitud de Nuevo Medicamento suplementaria para tabletas de fidaxomicina para el tratamiento de la diarrea asociada a Clostridioides difficile (CDAD) en niños de 6 meses en adelante.
La fidaxomicina es un medicamento antibacteriano macrólido indicado para el tratamiento de infecciones que se ha demostrado o se sospecha que son causadas por C. difficile. Además, la fidaxomicina está contraindicada en pacientes con hipersensibilidad conocida a la fidaxomicina o cualquier otro ingrediente de la fidaxomicina.
La aprobación de la fidaxomicina se basa en un estudio de grupo paralelo aleatorizado de fase 3 denominado SUNSHINE, donde se evaluó la seguridad y eficacia en pacientes de 6 meses a 18 años.
Se evaluaron ciento cuarenta y ocho pacientes aleatorizados con infección confirmada por C. difficile; 142 de estos pacientes recibieron fidaxomicina (suspensión o tabletas, dos veces al día) o vancomicina (suspensión o tabletas, 4 veces al día).
La respuesta clínica de CDAD en la población pediátrica general fue similar entre los grupos de fidaxomicina y vancomicina, evaluada durante 2 días después de 10 días de tratamiento. La proporción de pacientes tratados con respuesta clínica confirmada y sin recurrencia de CDAD hasta 30 días después del final del tratamiento fue mayor para fidaxomicina que para vancomicina.
La seguridad de la fidaxomicina se evaluó adicionalmente en un ensayo de fase 2, de una sola rama, de 38 pacientes y en un ensayo de fase 3, controlado de forma activa, de 98 pacientes tratados con fidaxomicina y 44 pacientes tratados con vancomicina. La interrupción del tratamiento debido a reacciones adversas se produjo en el 7,9% de los pacientes en el ensayo de fase 2, y en el 1% y el 2,3% de los pacientes tratados con fidaxomicina y vancomicina en el ensayo de fase 3.
Las reacciones adversas más comunes en pacientes pediátricos tratados con fidaxomicina en el ensayo de fase 3 fueron pirexia, dolor abdominal, vómitos, diarrea, estreñimiento, aumento de aminotransferasas y erupción cutánea.
Fuente: Pharmacy Times / COFA
La FDA aprueba un nuevo antibacteriano
La Administración de Medicamentos y Alimentos de los Estados Unidos (FDA) aprobó hoy Fetroja (cefiderocol), un medicamento antibacteriano para el tratamiento de pacientes de 18 años de edad o mayores con infecciones complicadas del tracto urinario (cUTI), incluidas infecciones renales causadas por microorganismos gram-negativos susceptibles, que tienen enfermedades limitadas o que no tienen opciones de tratamiento alternativas.
John Farley, M.D., M.P.H., director interino de la Oficina de Enfermedades Infecciosas en el Centro de Evaluación e Investigación de Medicamentos de la FDA advirtió que “un desafío global clave al que se enfrenta la FDA como agencia de salud pública es abordar la amenaza de infecciones resistentes a los antimicrobianos, como las cUTI. Esta aprobación representa otro paso adelante en los esfuerzos generales de la FDA para garantizar que los medicamentos antimicrobianos seguros y efectivos estén disponibles para los pacientes para el tratamiento de infecciones “.
La seguridad y efectividad de Fetroja se demostró en un estudio de 448 pacientes con cUTI. De los pacientes que recibieron Fetroja, el 72,6% resolvió los síntomas y la erradicación de la bacteria aproximadamente siete días después de completar el tratamiento, en comparación con el 54,6% de los pacientes que recibieron un antibiótico alternativo. Las tasas de respuesta clínica fueron similares entre los dos grupos de tratamiento.
El etiquetado de Fetroja incluye una advertencia sobre la tasa de mortalidad por todas las causas más alta observada en pacientes tratados con Fetroja en comparación con los tratados con otros antibióticos en un ensayo en pacientes críticos con infecciones bacterianas gramnegativas resistentes a múltiples fármacos. La causa del aumento de la mortalidad no se ha establecido. Algunas de las muertes fueron el resultado del empeoramiento o las complicaciones de la infección, o las comorbilidades subyacentes. La mayor tasa de mortalidad por todas las causas se observó en pacientes tratados por neumonía adquirida en el hospital, infecciones del torrente sanguíneo o sepsis. La seguridad y eficacia de Fetroja no se ha establecido para el tratamiento de este tipo de infecciones.
Las reacciones adversas más comunes observadas en pacientes tratados con Fetroja incluyeron diarrea, estreñimiento, náuseas, vómitos, elevaciones en las pruebas hepáticas, erupción cutánea, reacciones en el lugar de infusión, candidiasis (infección por hongos), tos, dolor de cabeza e hipocalemia (bajo contenido de potasio). Fetroja no debe usarse en personas con antecedentes conocidos de hipersensibilidad grave a los fármacos antibacterianos betalactámicos.
Fetroja recibió la designación de producto calificado de enfermedades infecciosas (QIDP) de la FDA. La designación QIDP se otorga a los medicamentos antibacterianos y antimicóticos destinados a tratar infecciones graves o potencialmente mortales de la Ley de seguridad e innovación de la FDA. Como parte de la designación QIDP, a Fetroja se le otorgó una Revisión prioritaria bajo la cual el objetivo de la FDA es tomar medidas sobre una solicitud dentro de un plazo acelerado.
La FDA otorgó la aprobación de Fetroja a Shionogi & Co., Ltd
Fuente: FDA
Argentina: primer medicamento específico para la dermatitis atópica severa
Aunque los cuadros más severos de la dermatitis atópica (DA) son menos frecuentes que las variantes leves de la enfermedad, se manifiestan con brotes en la piel, con picazón intensa y persistente, dolor, enrojecimiento, costras, secreciones y sobreinfecciones. Para controlarlos, había una clara necesidad insatisfecha: las alternativas terapéuticas disponibles no lograban mejorar significativamente las lesiones en la piel o producían efectos adversos considerables. Ahora, la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) aprobó en nuestro país el uso de una droga denominada dupilumab, indicada para tratar la dermatitis atópica severa en adultos.
La Dra. Carla Castro, médica dermatóloga, Coordinadora de la Unidad de Dermatitis Atópica del Servicio de Dermatología del Hospital Universitario Austral, detalla que
“es la primera terapia aprobada específicamente para la DA severa, con lo cual representa una muy buena noticia para los pacientes. Ahora este grupo específico que se ve más afectado por la enfermedad podrá contar con una nueva herramienta que ha demostrado resultados muy esperanzadores para mantenerla bajo control”.
En los estudios del programa de investigación clínica que avalan la seguridad y eficacia de dupilumab, se demostró que al año de iniciado el tratamiento, 2 de cada 3 pacientes (65%) presentaban una mejoría de al menos 75% de la extensión y severidad de sus lesiones. Asimismo, 4 de cada 10 pacientes (41%) mostraron una reducción de al menos 4 puntos en la escala numérica de la picazón (1-10) tras 16 semanas de comenzado el tratamiento.
En tanto el Dr. Pedro Herranz, Jefe de Servicio de Dermatología del Hospital Universitario La Paz, de Madrid, España, subraya que
“la disponibilidad de dupilumab supone un cambio de paradigma en el tratamiento de los pacientes con dermatitis atópica grave. Se trata del primer fármaco biológico dirigido expresamente a modificar las alteraciones inmunológicas que producen la enfermedad y que ha demostrado una gran eficacia en el tratamiento de estos pacientes, con un perfil de seguridad muy favorable”.
En cuanto al perfil de seguridad, dupilumab ha sido bien tolerado, siendo las molestias en el sitio de la inyección y la conjuntivitis los eventos adversos reportados con mayor frecuencia.
El verdadero impacto de esta enfermedad en la calidad de vida se ve en los casos moderados y severos. Tal como puntualizó Mariana Palacios, Presidente de la Asociación Dermatitis Atópica Argentina (ADAR), “los brotes pueden ser imprevistos y la picazón volverse tan intolerable que no te permite concentrarte en el trabajo, en los estudios, en una reunión social o en lo que sea que estés haciendo”.
En una encuesta que hicimos desde ADAR a pacientes argentinos, agregó la Sra. Palacios, “8 de cada 10 refirieron dormir mal por su enfermedad. A veces se los puede escuchar rascarse desde la otra habitación. Hasta ducharse puede doler, independientemente de la temperatura del agua. Por eso, es muy bueno que lleguen novedades para ayudar a estos pacientes”.
4 de cada 10 personas con DA severa sienten vergüenza por su condición y 1 de cada 2 se manifiesta frustrado por su enfermedad con frecuencia o siempre. Además, produce ausentismo laboral (el triple que una persona sana).
Mejor control de los casos severos
En su versión leve, la dermatitis atópica es frecuente, suele iniciarse en la infancia y la mayoría de las veces revierte con el tiempo. Sin embargo, 3 de cada 10 pacientes continúan padeciéndola tras la pubertad y también hay quienes comienzan a presentarla en la adultez. Es severa en cerca del 5% de los casos en adultos.
Los casos leves pueden controlarse con cremas emolientes, con corticoides tópicos y cuidados diarios de la piel, pero las personas con cuadros más complejos hasta ahora no obtenían respuestas satisfactorias con las opciones que tenían a disposición (fototerapia o terapias sistémicas inmunosupresoras como ciclosporina o metotrexato) y son los que más pueden beneficiarse con la novedad terapéutica, que es diferente de todo lo que había.
“Esta nueva medicación ayuda a controlar la alteración inmunológica de los pacientes de manera más específica. Por lo tanto, disminuye la inflamación de la piel sin alterar las funciones de las defensas. Uno de los problemas que tenemos con la dermatitis atópica es que el sistema inmunológico que está alterado para que se desarrolle la enfermedad es el mismo que nos defiende de las infecciones. Entonces, es importante que los tratamientos controlen este disbalance, sin afectar -en lo posible- los mecanismos de defensa de nuestro organismo. Ese es el caso de esta nueva alternativa terapéutica”, aportó la Dra. Castro, quien además integra el Grupo de Trabajo de Dermatitis Atópica de la Sociedad Argentina de Dermatología (SAD).
La dermatitis atópica se desarrolla por una respuesta hiperactiva del sistema inmune que origina un proceso inflamatorio donde intervienen dos interleuquinas, la 4 y la 13, que son proteínas con una importancia central en el desencadenamiento de este proceso. Dupilumab es la primera y única terapia biológica específica aprobada en nuestro país y lo que hace es inhibir simultáneamente esas dos proteínas.
“Hasta ahora, los pacientes con dermatitis atópica severa que necesitan el uso de fármacos sistémicos requerían inmunosupresores con el riesgo adicional de toxicidad potencialmente grave. A partir de la aparición de dupilumab, se abre una esperanza clara para estos pacientes, ya que el nuevo medicamento es mucho más eficaz que los hasta ahora disponibles y, según los datos a mediano plazo, sin asociación a efectos indeseables graves”, concluyó el Dr. Herranz.
“A los pacientes con cuadros más severos, que quizás en el pasado se hayan frustrado porque los tratamientos que había no eran todo lo efectivos que esperaban o su nivel de toxicidad era elevado -continuó la Dra. Castro- les recomendamos que vuelvan al consultorio del dermatólogo o del alergólogo, porque con las nuevas medicaciones los resultados son muy alentadores y el horizonte es completamente diferente de lo que era años atrás”.
Lo más visto
- Covishield, la vacuna que India lanzó con Oxford-AstraZeneca
- El gobierno establece los requisitos para la producción de cannabis medicinal
- Anmat aprobó en el país la primera vacuna que protege contra el dengue
- Comunicación de Novo Nordisk: Diferencias en la indicación de Victoza® y Saxenda®
- Ibupirac declarado apto para celíacos