Mostrando artículos por etiqueta: arterias
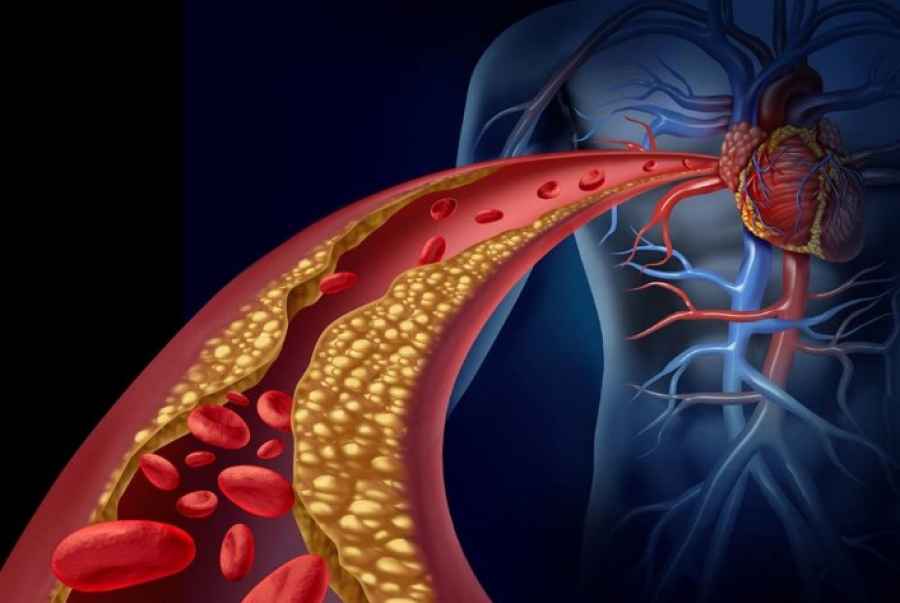
Descubren cómo el LDL entra en las paredes de las arterias
Investigadores de la UT Southwestern (Estados Unidos) han determinado cómo el LDL, conocido como ‘colesterol malo’, entra en las paredes de las arterias para causar la placa que estrecha los vasos sanguíneos y conduce a ataques cardíacos y accidentes cerebrovasculares.
El estudio, publicado en la revista ‘Nature’, revela por primera vez cómo una proteína llamada SR-B1 transporta partículas de LDL hacia y luego a través de las células endoteliales que recubren las arterias. Además, los investigadores también encontraron una segunda proteína denominada DOCK4 que se asocia con SR-B1 y es necesaria para este proceso.
En las primeras etapas de la aterosclerosis, el LDL que ha entrado en la pared arterial atrae y es engullido por importantes células del sistema inmunológico llamadas macrófagos que ‘comen’ partículas de LDL. Los macrófagos cargados de LDL se convierten en células que promueven la inflamación y el desarrollo de placas ateroscleróticas.
Las placas estrechan las arterias y pueden volverse inestables. Las placas que se rompen pueden activar la coagulación de la sangre y bloquear el flujo sanguíneo al cerebro o al corazón, lo que resulta en un accidente cerebrovascular o un ataque cardíaco. En estudios de ratones con colesterol elevado, los investigadores determinaron que la eliminación de la SR-B1 de las células endoteliales que recubren los vasos sanguíneos resultó en mucho menos LDL entrando a la pared arterial, menos células de espuma formadas y placas ateroscleróticas que eran considerablemente más pequeñas.
“Al comienzo de este trabajo era sorprendentemente desconocido cómo el LDL entra en la pared arterial para causar enfermedad cardiovascular. Los hallazgos del documento resuelven ese misterio y contrarrestan la suposición previa de muchos científicos de que el LDL simplemente entra a través de sitios de daño o disrupción en la capa única de células endoteliales que sirve como barrera protectora de la pared de la arteria”, explica el autor principal del trabajo, Philip Shaul.
Fuente: Europa Press / COFA
Logran reducir el daño por estrés oxidativo que la diabetes causa en las arterias y riñones
| Investigadores españoles demuestran que la terapia basada en la familia de proteínas supresoras de la señalización de citocinas reduce la acumulación de radicales libres en células de las arterias y el riñón. | ||
|
|
||
| Investigadores del Centro de Investigación Biomédica en Red de Diabetes y Enfermedades Metabólicas Asociadas (CIBERDEM) en el Instituto de Investigación Sanitaria del Hospital Universitario Fundación Jiménez Díaz (IIS-FJD) y la Universidad Autónoma de Madrid (UAM) han descrito un nuevo abordaje terapéutico para combatir la inflamación y el estrés oxidativo en los tejidos dañados por la diabetes y, de este modo, frenar la progresión de las complicaciones crónicas asociadas a esta enfermedad.
El equipo investigador, liderado por los doctores Jesús Egido y Carmen Gómez-Guerrero, ha demostrado de forma experimental que la terapia basada en la familia de proteínas SOCS reduce de forma efectiva la presencia de radicales libres en las arterias y el riñón, dos territorios muy susceptibles de sufrir daño por los niveles altos de glucosa y donde en mayor proporción se presentan las complicaciones de la diabetes. El estudio fue publicado en la revista Laboratory Investigation. La diabetes es una enfermedad que está alcanzando proporciones epidémicas y es una causa importante de muerte en todo el mundo. Se estima que, en la actualidad, más de 400 millones de personas en el mundo padecen diabetes, muchas de las cuales todavía están sin diagnosticar. El gran impacto sociosanitario de esta enfermedad es debido, en parte, a la importancia de sus complicaciones crónicas, ya que los niveles elevados de glucosa en sangre deterioran a largo plazo la funcionalidad de diferentes tejidos como riñón, ojo, nervios y sistema cardiovascular. De hecho, la aterosclerosis es una frecuente complicación cardiovascular causada por la diabetes y la principal responsable de la morbilidad y mortalidad de los pacientes con diabetes tipo 1 y 2. La afectación renal (nefropatía diabética) está presente en aproximadamente un tercio de los pacientes con diabetes y es la causa principal de entrada en programas de diálisis y trasplante, además de aumentar el riesgo de enfermedad cardiovascular. El estrés oxidativo es un mecanismo implicado en el desarrollo y progresión de las complicaciones crónicas de la diabetes, entre ellas la aterosclerosis y la nefropatía diabética. El estrés oxidativo se produce por un desequilibrio en el balance redox de la célula que puede ser debido tanto a la producción excesiva de radicales libres por los sistemas pro-oxidantes, como al deterioro de los sistemas de defensa antioxidante. Este desequilibrio es causante de alteraciones oxidativas en diferentes macromoléculas, como el DNA, las proteínas y los lípidos, que afectan negativamente a la funcionalidad celular. Reducción del daño oxidativo en arterias y riñón El tratamiento propuesto en este estudio ha demostrado tener un efecto beneficioso porque consigue reducir el daño por estrés oxidativo que la diabetes causa en las células de las arterias y el riñón. Los investigadores han analizado el efecto antioxidante de la proteína SOCS1, un miembro de la familia de supresores de la señalización de citocinas. Esta proteína endógena es un importante regulador negativo de JAK/STAT, la vía de señalización intracelular que está activada de forma crónica en el entorno diabético y que es responsable de la expresión de genes implicados en inflamación y estrés oxidativo. El estudio se realizó en ratones con diabetes, en los que se ensayaron dos abordajes experimentales: la terapia génica con un vector viral para expresar la molécula SOCS1 completa y el empleo de un péptido sintético que imita la funcionalidad de esta proteína. Los dos abordajes experimentales planteados fueron beneficiosos en los ratones diabéticos, aunque el péptido derivado de SOCS1 mostró tener una mayor reducción del estrés oxidativo tanto in vitro como in vivo y un superior efecto protector frente a la diabetes. Este tratamiento fue capaz de reducir los niveles de marcadores de oxidación en el vaso y el riñón de los animales diabéticos y de inhibir la expresión y la actividad de las subunidades de la NADPH oxidasa, el principal complejo enzimático pro-oxidante y generador de radicales libres en la diabetes. Además, el estudio demuestra que la terapia basada en las proteínas SOCS promueve la expresión de enzimas antioxidantes (catalasa, superóxido dismutasa, etc.), por lo que proporcionaría una doble línea de acción para combatir el estrés oxidativo en la diabetes. Este potente efecto antioxidante del tratamiento se correlacionó con una mejora de la función renal de los animales diabéticos y con una reducción en el tamaño de sus placas de ateroma. Sin efectos adversos en cultivos y animales “Hoy en día tenemos una importante necesidad de encontrar nuevos tratamientos capaces de frenar o controlar el deterioro de los tejidos afectados por la diabetes, entre ellos la el sistema cardiovascular y el riñón”, apunta la investigadora Gómez-Guerrero. “Los tratamientos habituales basados en el estricto control del peso, la dieta, los niveles de glucemia y la tensión arterial, aunque son efectivos, resultan todavía insuficientes pues no evitan en muchos de nuestros pacientes el riesgo de un evento cardiovascular o el deterioro de su función renal y la progresión a enfermedad renal crónica”, explica el Dr. Egido. En este sentido, señala Gómez-Guerrero, “nuestro equipo propone un abordaje que no presenta efectos adversos en cultivos celulares y animales diabéticos, y que podría servir para retardar la progresión del daño por estrés oxidativo en las complicaciones crónicas de la diabetes”. El uso de este compuesto está protegido por una patente internacional que cubre una necesidad médica importante como son las complicaciones vasculares de la diabetes, del que ya se ha iniciado la fase de desarrollo preclínico con la intención de pasar a las primeras fases de ensayos con pacientes en un futuro. Fuente: Jano On Line |
Lo más visto
- Covishield, la vacuna que India lanzó con Oxford-AstraZeneca
- El gobierno establece los requisitos para la producción de cannabis medicinal
- Anmat aprobó en el país la primera vacuna que protege contra el dengue
- Comunicación de Novo Nordisk: Diferencias en la indicación de Victoza® y Saxenda®
- Ibupirac declarado apto para celíacos