Mostrando artículos por etiqueta: Anmat
ANMAT recomendó el uso de la vacuna SINOPHARM en mayores de 60 años
La ministra de Salud de la Nación, Carla Vizzotti, anunció que la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) recomendó al Ministerio de Salud de la Nación autorizar el uso de emergencia de la vacuna SINOPHARM en el grupo de mayores de 60 años.
De esta forma, la vacuna provista por el Beijing Institute of Biological Products Co Ltd., podrá utilizarse en nuestro país para avanzar en la inmunización de este grupo de riesgo.
La ANMAT indicó que la seguridad analizada en el ensayo de Fase III entre el grupo de vacunados y el grupo placebo, resulta con un perfil aceptable y hasta el momento del análisis no hubo eventos adversos inesperados o graves relacionados al producto.
La inmunogenicidad correspondiente al grupo etario de mayores de 60 años presenta una cantidad de anticuerpos neutralizantes compatible con el de menores de 59 años.
El análisis interino reportó que la eficacia determinada con el ensayo clínico en el que participaron 25.730 voluntarios, es 78,89%.
La ministra comunicó la recomendación durante un encuentro con integrantes de la Comisión Nacional de Inmunizaciones (CONAIN) donde se analizan permanentemente las distintas estrategias de vacunación para fortalecer la respuesta a una segunda ola de casos de COVID-19.
La ANMAT permitirá la importación de productos con derivados del cannabis
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) permitirá la importación de productos con derivados del cannabis para uso medicinal.
A través de la Resolución 654/2021, publicada este jueves en el Boletín Oficial, el Ministerio de Salud de la Nación aprobó el Régimen de Acceso de Excepción "a productos que contengan cannabinoides o derivados de la planta de cannabis destinados exclusivamente para uso medicinal, ya sea para el tratamiento de un paciente individual o bien dentro del contexto de una investigación científica"
El mencionado régimen se aplicará “cuando no existan registros sanitarios en el país” de los productos mencionados o cuando los mismos “se encuentren en fase de investigación y en forma exclusiva para las patologías que revistan evidencia de calidad metodológica” determinada por la cartera sanitaria.
Los productos importados que serán autorizados por la ANMAT para el tratamiento de pacientes individuales “deberán ser prescriptos por profesionales médicos matriculados ante autoridad sanitaria competente, bajo su exclusiva responsabilidad sobre la calidad, seguridad y eficacia del producto indicado, mediante receta ajustada a normativa vigente”. En primer término, el trámite se realizará mediante la plataforma de “Trámites a Distancia”, pero dicha administración ofrecerá alternativas para el paciente o sus representantes.
La solicitud de importación para el tratamiento de pacientes individuales se realizará conforme lo dispuesto por la ANMAT oportunamente. Se autorizará a importar la cantidad de producto necesaria para cubrir un tratamiento de hasta 180 días corridos. La autorización será constancia suficiente para presentar ante la Dirección General de Aduanas. “La validez del formulario será de 180 días corridos a partir de la fecha consignada en dicha autorización”, se precisó.
La ANMAT mantendrá tanto la nómina de pacientes que accedan a los productos, como también de los médicos que los prescriban.
En el caso de la importación de derivados del cannabis para investigación médica y científica, el patrocinante deberá presentar la autorización del estudio para poder solicitar la importación de las cantidades autorizadas en el protocolo a través de los procedimientos establecidos en las normas vigentes de la ANMAT.
Para todo ingreso del producto indicado a un paciente, “la ANMAT podrá solicitar la información actualizada y disponible sobre el uso y comercialización del producto”. Podrá conformar grupos de trabajo para cada caso en particular y convocar a sociedades científicas especializadas a fin de requerir opinión. Además, podrá plantear consideraciones especiales referidas a aspectos éticos, clínicos y estadísticos, entre otros.
Los pacientes que a la fecha de entrada en vigencia de la presente resolución hayan accedido, a través del régimen de excepción de importación que rige actualmente, a un producto específico que contenga cannabinoides o derivados de la planta de cannabis, “podrán continuar con la importación del producto en cuestión”.
“Aquellas solicitudes que se encuentren en trámite y no se encuentren autorizadas por el funcionario responsable de la ANMAT a la fecha de la entrada en vigencia de la presente norma, serán evaluadas y/o autorizadas conforme a los plazos previstos en la presente medida”, se indicó.
Desde la cartera que conduce Ginés González García justificaron las investigaciones científicas para el uso medicinal del cannabis, ya que “el Estado debe facilitar el acceso a aquellas personas que no posean cobertura de salud”.
“La evidencia científica existente sobre el uso medicinal, terapéutico y/o paliativo del dolor de la planta de cannabis, sus derivados y tratamientos no convencionales no tiene un carácter restrictivo sobre la facultad del médico para prescribir, sin embargo se estima conveniente la intervención de profesionales médicos especialistas a los fines de extremar los cuidados sobre el paciente y garantizar el seguimiento de la eficacia y seguridad de los productos en cuestión”.
“En virtud de la experiencia referida por médicos, usuarios y familiares sobre la mejoría sintomática de pacientes tratados con determinados productos que contienen cannabinoides o derivados de la planta de cannabis, diferentes al producto registrado en el país y que se importan por el Régimen de Acceso de Excepción, resulta necesario permitir la continuidad de los tratamientos ya iniciados”, se remarcó en los considerando de la presente resolución.
Pfizer pidió autorización a la ANMAT para utilizar su vacuna en Argentina
El titular del Ministerio de Salud, Ginés González García, confirmó que el laboratorio Pfizer presentó este miércoles la documentación a la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) para que autorice el uso de su vacuna en Argentina.
"Hoy se presentó en el ANMAT Pfizer para autorizar la vacuna en la Argentina", dijo el funcionario y explicó que el procedimiento "exige toda la documentación de los estudios que se han hecho".
Según indicó el ministro de Salud en diálogo con el programa de Nelson Castro por radio Rivadavia, ante la urgencia que impone la pandemia "lo que se está haciendo es una cuestión más rápida de autorización".
"Claramente si lo consiguieron en Inglaterra es porque tienen toda esta fase", apuntó.
Si bien el ministro no dio fecha para que se complete el proceso de autorización, consideró que a su juicio Pfizer "tiene holgadamente todo lo que tiene que tener" para conseguir el aval de la ANMAT.
"Si aprobó el Reino Unido yo estoy convencido en que tiene holgadamente todo lo que tiene que tener, pero no puedo anticiparlo porque no depende de mi, es una decisión técnica", explicó.
Gran Bretaña se convirtió este miércoles en el primer país del mundo en aprobar la vacuna Pfizer/BioNTech COVID-19 para su uso, que se implementará desde la próxima semana.
Preocupa que sigan usándose soluciones endovenosas en envases prohibidos
La Asociación Argentina de Enfermeros en Control de Infecciones (ADECI) y la Asociación de Terapia de Infusión y Seguridad del Paciente (ATISPA) expresaron su preocupación por el incumplimiento de una disposición de la ANMAT (N° 11.857-E/2017) mediante la cual se obliga a todos los fabricantes de 'soluciones parenterales de gran volumen' (comúnmente conocidos como 'sueros'), que éstas sean administradas bajo la tecnología de 'sistema cerrado', que consiste en un tipo de envase que garantiza la esterilidad del contenido y una asepsia superior, ofreciendo una mayor seguridad para el tratamiento de los pacientes.
Estas soluciones, que se administran por vía endovenosa, se utilizan a diario, y constituyen uno de los insumos críticos de cualquier centro de salud. Entre los sueros más utilizados se encuentran la solución fisiológica y la solución dextrosa, las cuales son empleadas para: hidratar a los pacientes, reponer volumen plasmático, y como vehículo para aditivar fármacos para el tratamiento de distintas patologías más complejas.
Si bien dicha disposición entró en vigencia en 2017, la autoridad sanitaria otorgó 2 años para que las empresas se reconvirtieran y adaptaran sus procesos de fabricación al sistema cerrado, utilizado internacionalmente por su mayor seguridad. Sin embargo, a un año de su entrada final en vigencia (noviembre '19) algunos fabricantes siguen comercializando sus soluciones endovenosas con la tecnología anterior (sistema abierto) desoyendo las disposiciones de la autoridad sanitaria, perjudicando la salud y la seguridad de los pacientes.
Entre otros beneficios, en un envase de sistema cerrado no hay entrada de aire desde el exterior en ningún momento, lo que minimiza las posibilidades de que algún agente infeccioso ingrese al organismo de los pacientes a través de la vía endovenosa. Por otra parte, en el sistema abierto, los recipientes no colapsan conforme se vacía la solución, como sí lo hacen los envases de sistema cerrado, lo cual supone un riesgo en su manipulación.
Por razones desconocidas, muchos centros de salud continúan utilizando sueros en sistema abierto, sabiendo que son menos seguros para el paciente. "Contando con una disposición de la entidad regulatoria que prohíbe su comercialización, lo lógico sería abandonar el uso de esta tecnología obsoleta e insegura, y estar en línea con la tendencia mundial", señalan desde las entidades.
"Todos los argumentos lógicos apuntan a utilizar el sistema cerrado: es el único aprobado, es más seguro, el más práctico, implica menor tiempo de preparación y manipulación hasta su instalación y requiere la utilización de menos elementos adicionales. Como enfermeros en control de infecciones y velando por la seguridad del paciente al tratar de minimizar la ocurrencia de bacteriemias, solicitamos que se regularice esta situación", consignó la Lic. Elena Graciela Andión, Licenciada en Enfermería y Presidenta de la Asociación Argentina de Enfermeros en Control de Infecciones (ADECI).
En esta misma línea, los enfermeros manifestaron que demoran más en preparar un envase de sistema abierto, que implica la realización de 12 pasos, en comparación con uno de sistema cerrado, que requiere de solo 6 pasos. En consecuencia, la nueva tecnología permite la preparación de manera más rápida, lo que ahorra tiempo valioso durante el cual el personal de enfermería puede realizar otro tipo de tareas.
Estos envases se utilizan para la infusión de soluciones, por lo general en un contexto de internación. Su contenido puede ir desde una solución fisiológica hasta fármacos. "Son un elemento básico de trabajo en cualquier centro de salud. Que se sigan utilizando recipientes obsoletos y prohibidos no es bueno para la Salud argentina", describió la Lic. Cirlia Petrona Álvarez, Licenciada en Enfermería y Presidenta de la Asociación de Terapia de Infusión y Seguridad del Paciente (ATISPA).
En contrapartida, hay laboratorios, tanto nacionales como internacionales, que sí han acatado la disposición de ANMAT y han hecho una inversión significativa para migrar de tecnología y brindar productos más seguros alineados con los estándares internacionales de cuidado. "Por ello, además de un problema de salud pública por aceptar la comercialización de soluciones endovenosas en envases fuera de la normativa vigente, se crea una desigualdad comercial que castiga a aquellos que se han reconvertido", concluyeron.
Pfizer presenta nueva droga para subtipo de cáncer de pulmón
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) aprobó un nuevo tratamiento para pacientes adultos con Cáncer de Pulmón de Células No Pequeñas (CPCNP) metastásico positivo para la quinasa del linfoma anaplásico (ALK, por sus siglas en inglés), que tienen progresión de la enfermedad después de haber recibido tratamiento con inhibidores de la tirosina cinasa (TKI, por sus siglas en inglés) de ALK de primera y/o segunda generación. Gracias al nuevo medicamento, este grupo de pacientes podría contar por primera vez con una nueva opción segura y eficaz como alternativa a la quimioterapia.
La nueva droga, denominada lorlatinib, corresponde a un desarrollo del laboratorio Pfizer y en opinión de los especialistas representa un avance revolucionario de la ciencia que podría traducirse en beneficios significativos para los pacientes con este subtipo de cáncer de pulmón. “A partir de ahora, un grupo de pacientes que no tenía otras opciones luego de recibir tratamiento con este tipo de inhibidores, ahora podría disponer de una nueva alternativa terapéutica disponible en la Argentina, que demostró alcanzar importantes beneficios”, dijo el Dr. Claudio Martín, médico oncólogo, Jefe de Oncología Torácica del Instituto Alexander Fleming.
En Argentina, el cáncer de pulmón es el de mayor mortalidad, por encima de los de colon, mama, páncreas y próstata y el cuarto en incidencia, con alrededor de 11 mil nuevos casos por año, lo que representa el 9,3% del total de casos de cáncer.
El tipo de cáncer de pulmón denominado ‘de células no pequeñas’ representa entre el 80% y el 85% de los casos de cáncer de pulmón, de los cuales entre el 3% y el 5% corresponden a la mutación ALK. En Argentina, ese porcentaje asciende a 6,1%. Las personas con cáncer de pulmón ALK positivo poseen un perfil diferente al de los demás pacientes con cáncer de pulmón: es más probable que sean mujeres, que la enfermedad se manifieste antes de los 50 años de edad y que nunca hayan fumado o hayan fumado poco.
La falta de conocimiento acerca del cáncer de pulmón constituye también un desafío importante. En general, existe poca conciencia acerca de la enfermedad, sus causas y síntomas, lo que muchas veces demora el diagnóstico. Cerca del 85% de los casos de cáncer de pulmón en América Latina se diagnostican en una etapa avanzada.
Al mismo tiempo, el estigma que relaciona la enfermedad con el tabaquismo puede disuadir a las personas que presentan síntomas de buscar ayuda médica. Sin embargo, cerca del 36% de los casos de cáncer de pulmón son causados por factores diferentes al consumo de tabaco, incluyendo la contaminación, el gas radón residencial y la presencia de arsénico en el agua.
En cuanto al tratamiento del cáncer de pulmón ALK+, si bien la progresión de la enfermedad es prácticamente inevitable, el reto consiste en incrementar las tasas de supervivencia por hasta alrededor de cinco años. La mayoría de los tumores desarrollan resistencia a los tratamientos iniciales y esto lleva a que los pacientes tal vez deban buscar una segunda y hasta una tercera línea de tratamiento en el plazo de uno a tres años. En el pasado, no se contaba con opciones eficaces después del fracaso de la terapia con inhibidores de la tirosina quinasa (TKI) de ALK de primera y segunda línea, por lo que se debía proceder con la quimioterapia, con sus efectos secundarios impactando en la calidad de vida de los pacientes.
La Dra. Lorena Lupinacci, médica oncóloga de planta de la sección de oncología clínica del Hospital Italiano de Buenos Aires, afirma que “hasta hace poco tiempo eran pocas las alternativas terapéuticas con que contábamos para este tipo de cáncer de pulmón: básicamente cirugía, quimioterapia y radiación, o combinaciones de éstas. En los últimos años la incorporación de los inhibidores de la tirosina quinasa de ALK de primera y segunda generación han traído luz al pronóstico en ese grupo de pacientes. Con la llegada de lorlatinib, sin dudas dispondremos de una nueva alternativa de tratamiento muy eficaz que abre una gran esperanza para estos pacientes”.
Lorlatinib es un potente inhibidor de la tirosina quinasa de linfoma anaplásico (ALK por su sigla en inglés) de tercera generación, dirigido al espectro más amplio de mutaciones con resistencia secundaria relacionada con ALK producto de tratamientos anteriores. Como primer y único tratamiento basado en marcadores biológicos y destinado a pacientes que presentan progresión de la enfermedad después de recibir TKI de ALK de segunda generación, lorlatinib fue diseñado específicamente para tratar mutaciones que los TKI de ALK de segunda generación no han logrado tratar.
El cáncer de pulmón ALK positivo también tiene mayores probabilidades de propagarse al cerebro, el cual está protegido por una barrera altamente selectiva, llamada barrera hematoencefálica. Las metástasis cerebrales están presentes en hasta un 25% de los pacientes al momento del diagnóstico y hasta un 60 % después de 3 años. Lorlatinib atraviesa esta barrera y alcanza las células tumorales del cerebro, por lo que brinda otra línea de tratamiento innovador para los pacientes con cáncer de pulmón ALK positivo, con progresión de la enfermedad.
En los últimos años, la ciencia ha determinado que existen distintos tipos de cáncer de pulmón, definidos por perfiles de marcadores biológicos únicos. Esto significa que, aunque pueda parecer que dos pacientes tengan el mismo tipo de cáncer, es posible que respondan de manera diferente a igual tratamiento.
“Los estudios de marcadores biológicos, determinados por los análisis de muestras tumorales, han cambiado la forma de analizar, diagnosticar y tratar el cáncer de pulmón, lo que demuestra la importancia de personalizar los medicamentos que se utilizan para tratar el cáncer de pulmón según el marcador biológico específico de cada paciente. A ese respecto, ya se han desarrollado tres generaciones de inhibidores TKI de ALK. Cada generación es más potente, más selectiva y tiene mayor penetración en el cerebro que la anterior” sostiene la Dra. Lupinacci.
Peter Czanyo, Fundador y Presidente de la "Fundación Pacientes de Cáncer de Pulmón" (FPCP) puso foco en la necesidad de trabajar para poder disponer de todos los dispositivos necesarios para mejorar el acceso y destacó la importancia de la prevención primaria y, sobre todo, de la prevención secundaria. “Como ex paciente de cáncer de pulmón y en representación de la Fundación, pienso que el foco de los esfuerzos debe estar en la concientización y en las responsabilidades tanto del sistema como de las personas, para poder aprovechar ésta y otras novedades terapéuticas de la mejor manera. El escenario de hoy para el cáncer de pulmón es muy diferente al que yo enfrenté, es muy esperanzador ver cómo surgen alternativas para los diferentes casos. Entendemos la importancia de los test moleculares para poder conocer cada tumor, eso es necesario que esté disponible. Además, confiamos en que la herramienta del screening contribuirá a reducir sensiblemente los tiempos de acceso al diagnóstico y eso es lo que va a determinar mejoras en el pronóstico a favor de los pacientes", afirmó.
La nueva droga recibió la aprobación, entre otros, por parte de los países que conforman la Unión Europea, mientras que en los Estados Unidos fue autorizada en el marco del ‘Programa de Aprobación Acelerada’ de la Administración de Alimentos y Medicamentos (FDA por su sigla en inglés), en función de la respuesta tumoral y la duración de la misma. Un 40,3% de los pacientes tratados con Lorlatinib después de un inhibidor de segunda generación experimentaron al menos una disminución parcial, o incluso completa, de sus tumores.
Sin un tratamiento de tercera línea, la supervivencia media para los pacientes con cáncer de pulmón ALK positivo en estadio IV es de 6,8 años. Lorlatinib podría permitir que los pacientes tengan al menos 6,9 meses más de supervivencia sin progresión, después de recibir tratamientos con TKI de ALK de primera y/o segunda generación. Además, pacientes tratados con la nueva droga presentaron una importante mejora en su bienestar físico, emocional y social, incluido el alivio de los síntomas del cáncer de pulmón.
“Estos resultados son muy apreciados por los pacientes y sus familiares, y obviamente por los médicos especialistas, que estamos poco acostumbrados a este tipo de respuestas en el tratamiento de una enfermedad oncológica tan severa. Se abre una alentadora esperanza y vemos con beneplácito la llegada de esta nueva droga a las herramientas terapéuticas disponibles”, agregó el Dr. Martín.
Con la disponibilidad de lorlatinib, Pfizer ahora cuenta con medicamentos para tratar a pacientes con tres tipos de cáncer de pulmón definidos por marcadores biológicos: traslocaciones de ALK, mutaciones en el gen EGFR y fusiones de ROS1. Esto representa un gran avance para los pacientes con diversas necesidades en evolución en varios marcadores biológicos para el cáncer de pulmón.
A través del estudio CROWN en fase 3, Pfizer continúa investigando el potencial de Lorlatinib para el tratamiento de los pacientes con cáncer de pulmón ALK positivo. El estudio compara el uso de lorlatinib y crizotinib como tratamiento de primera línea para pacientes con cáncer de pulmón ALK positivo, con un pronóstico alentador respecto a la mejora en la sobrevida libre de progresión.
Acerca de lorlatinib
Lorlatinib es un inhibidor de tirosina quinasa (TKI) que ha demostrado estar muy activo en modelos preclínicos de cáncer de pulmón que albergan reordenamiento cromosómico de ALK. Se desarrolló específicamente para inhibir las mutaciones tumorales que presentan resistencia a otros inhibidores de ALK y para atravesar la barrera hematoencefálica. Lorlatinib obtuvo la aprobación en la UE en monoterapia como tratamiento para pacientes adultos con CPCNP avanzado positivo para ALK y que tienen progresión de la enfermedad después de:
- recibir alectinib o ceritinib como primera terapia con TKI de ALK; o
- crizotinib y por lo menos otro TKI de ALK.
Primera formulación pediátrica de medicamento para el chagas
El grupo de Parasitología – Chagas, del Instituto Multidisciplinario de Investigación en Patologías Pediátricas (IMIPP, CONICET-Gobierno de la Ciudad de Buenos Aires), en el Hospital de Niños ‘Ricardo Gutiérrez’, coordinó los estudios clínicos de una formulación pediátrica, inédita, de un medicamento utilizado en el tratamiento de la enfermedad de Chagas -el nifurtimox-, que se adapta a las necesidades especiales de los pacientes pediátricos desde recién nacidos hasta los 18 años de edad.
Los resultados sobre la formulación pediátrica esta droga, una de los dos desarrolladas hace 5 décadas para el uso en la enfermedad en adultos, resultaron en la aprobación por la Administración de Alimentos y Drogas de los Estados Unidos (FDA, por sus siglas en inglés), por lo que a nivel local estará de manera expeditiva aprobado su uso por ANMAT.
“Este es un gran logro de la pediatría argentina y latinoamericana, que a partir de una red de investigación clínica con altos estándares de calidad, obtuvo respuesta a una necesidad regional que impactará en la atención de los más vulnerables”, consideró el Dr, Jaime Altcheh pediatra e investigador principal del CONICET, quien lidera el equipo de trabajo.
Utilizar, como hasta el momento, las presentaciones de adultos y adaptarlas a los niños conlleva un problema, y es que cuando se fraccionan las pastillas, no puede asegurarse que la concentración de la droga es la misma en cada parte. Esto genera el riesgo de dar menores o mayores dosis a las necesarias. “El desarrollo y validación, en estudios clínicos, de una formulación dispersable adaptada para niños resuelve este problema y facilitara el tratamiento”, aclara el investigador.
El estudio se llevó a cabo en 25 sitios de investigación, que conforman la Red de Investigación Clínica PEDCHAGAS, en Argentina, Bolivia, y Colombia entre 2016 y 2018, en conjunto con el laboratorio Bayer. Se trató de un ensayo clínico de fase III prospectivo, donde se evaluó la eficacia, seguridad y farmacocinética de nifurtimox en 330 niños con enfermedad de Chagas.
“A pesar de estar aprobados para su uso en adultos desde la década del 70, es la primera vez que se hace un estudio farmacológico multicéntrico en pacientes pediátricos de este medicamento”, explica Altcheh.
Enfermedad de Chagas
El Chagas es una enfermedad causada por el parásito Trypanosoma cruzi, que transmite hacia el humano la vinchuca -Triatoma infestans-. También puede ser contagiado por transfusión sanguínea o trasplante de órganos, y durante la gestación, o por alimentos. Según datos publicados por la OMS, se calcula que en el mundo existen entre 6 a 7 millones de infectados, y en la Argentina, según estimaciones de la Sociedad Argentina de Pediatría, nacen 1200 niños con la enfermedad.
Diabetes tipo 2: nuevo tratamiento para adolescentes y niños
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) autorizó el uso de liraglutida para el tratamiento de adolescentes y niños a partir de 10 años de edad, con diabetes mellitus tipo 2 insuficientemente controlada como adyuvante de la dieta y ejercicio. Esta medicación ya estaba disponible en nuestro país para adultos. Más allá de la insulina y la metformina, la liraglutida es el primer tratamiento que obtiene la aprobación para uso pediátrico en diabetes tipo 2.
"Para niños y adolescentes con diabetes es una muy buena noticia que se aprueben más alternativas terapéuticas con mecanismos de acción diferentes. Sin ninguna duda, es un avance que va a permitir que logremos un mejor control de la diabetes tipo 2 en este grupo de pacientes", expresó la Dra. Margarita Barrientos, endocrinóloga pediatra, investigadora principal de estudios clínicos en México.
"Ciertamente existía una necesidad insatisfecha de contar con más opciones terapéuticas, pero la clave es que sean medicaciones que demuestren ser eficaces y seguras para su uso pediátrico", agregó la Dra. Margarita Barrientos.
Aunque, históricamente, la diabetes tipo 2 era una enfermedad que se daba principalmente en adultos, la Organización Mundial de la Salud indica que es cada vez más frecuente en niños y adolescentes.
Este incremento está impulsado por la epidemia mundial de obesidad infantil, desencadenada entre otras causas por malos hábitos alimenticios y vida sedentaria. En nuestro país, el exceso de peso (sobrepeso + obesidad) está presente en el 13,6% de los menores de 5 años y en el 41,1% de quienes tienen entre 5 y 17 años.
"Lamentablemente, lo que antes era inusual hoy es una realidad frecuente en nuestro consultorio. Hoy, esta enfermedad aparece en edades tempranas y no hay tiempo que perder", sostuvo la Dra. Barrientos.
"El tratamiento recomendado para la diabetes tipo 2 en pediatría es similar al de los adultos, con énfasis en un enfoque gradual que comienza con modificaciones en el estilo de vida, particularmente alimentación saludable y ejercicio físico, seguido por el uso de un tratamiento farmacológico único y luego -de ser necesario- por la combinación de dos medicamentos. El objetivo es que el paciente logre y mantenga niveles adecuados de glucosa en sangre para prevenir complicaciones a largo plazo", aseguró la Dra. Laura Pomares, Médica de Planta del Servicio de Endocrinología y Diabetes del Hospital 'Juan Pablo II' de Corrientes.
Hasta ahora, las dos únicas opciones de tratamiento aprobadas en niños y adolescentes con diabetes tipo 2 eran la metformina y las insulinas. Sin embargo, más de la mitad de los pacientes jóvenes no logra el control glucémico sostenido con metformina como monoterapia, inclusive cuando se combina con intervenciones en el estilo de vida. El tratamiento con insulina requiere de rutinas bien establecidas para minimizar el riesgo de hipoglucemia, un desafío en sí mismo en niños y adolescentes.
La diabetes tipo 2 es una enfermedad crónica en la que el páncreas no produce suficiente insulina para controlar el nivel de glucosa (azúcar) en la sangre o el cuerpo no puede usarla de manera efectiva. Puede provocar complicaciones para la salud a largo plazo si la persona no controla adecuadamente su enfermedad.
La Dra. Laura Pomares explicó que "la liraglutida es un 'análogo de incretina', es decir, que actúa imitando el funcionamiento metabólico de esa hormona en el organismo, cuyo rol es estimular la liberación de insulina por el páncreas en respuesta a los alimentos. De esta manera, ayuda a controlar los niveles de glucosa en sangre. Ya conocemos muy bien esta medicación, porque existe amplia evidencia y experiencia en adultos en los últimos 10 años".
La eficacia y seguridad de este medicamento en niños y adolescentes se investigó en el ELLIPSE, un estudio clínico de fase 3, controlado con placebo, que incluyó 134 pacientes con diabetes tipo 2, de 10 a 17 años y se llevó a cabo en 84 centros en 25 países.
En combinación con metformina, con o sin insulina basal, liraglutida (1,8 mg/día) redujo significativamente los niveles de hemoglobina glicosilada (un indicador que promedia los valores de glucemia en los últimos tres meses) tanto a las 26 como a las 52 semanas, versus placebo, donde la hemoglobina glicosilada aumentó, demostrando la superioridad de liraglutida en el control glucémico.
Además, la proporción de niños y adolescentes que en la semana 26 alcanzaron un valor de hemoglobina glicosilada inferior a 7% (nivel objetivo para un adecuado control de la enfermedad) fue significativamente mayor en aquellos que recibieron liraglutida (63.7%) que en los pertenecientes al otro grupo (36.5%).
El perfil de seguridad del medicamento en esta población es similar al ya conocido en la población de adultos.
Estos datos se suman a la extensa evidencia del uso de liraglutida en el tratamiento de la diabetes tipo 2 y al compromiso de Novo Nordisk en abordar una considerable y creciente necesidad médica insatisfecha para toda la población de pacientes con diabetes.
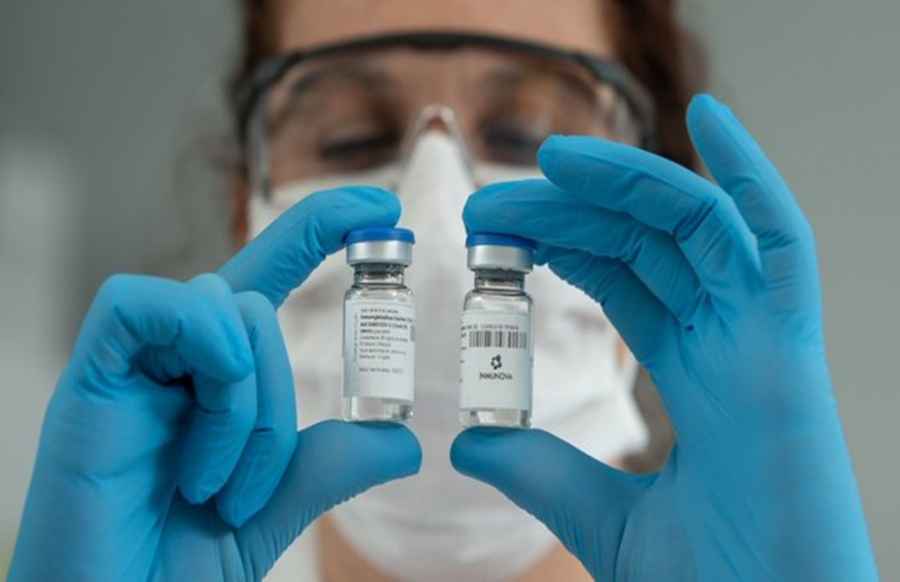
ANMAT aprobó protocolo de investigación para el estudio clínico del suero hiperinmune anti-COVID-19
Inmunova anunció hoy que la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) aprobó el protocolo de investigación del estudio clínico de Fase 2/3 del suero hiperinmune anti-COVID-19, que evaluará su seguridad y eficacia en el tratamiento de pacientes con infección por SARS-CoV-2.
El estudio clínico comenzará la semana próxima en el Sanatorio Güemes, en el Hospital General de Agudos “Dr. Ignacio Pirovano", ambos de CABA, en el Hospital Cuenca Alta - SAMIC de Cañuelas y en el Instituto Médico Platense de La Plata. Próximamente iniciará en más de diez hospitales y clínicas de obras sociales del área metropolitana de Buenos Aires y La Plata. Incluye la participación voluntaria de 242 pacientes adultos con enfermedad moderada a severa causada por la infección del SARS-CoV-2 confirmada por PCR, dentro de los diez días del inicio de síntomas y que requieren hospitalización.
El suero anti-COVID-19 es el primer potencial medicamento innovador para el tratamiento de la infección por el nuevo coronavirus totalmente desarrollado en Argentina.
En ensayos in vitro demostró la capacidad de neutralizar el virus, con una potencia alrededor de 50 veces mayor que el promedio del plasma de convalecientes. Este desarrollo y los resultados de estas pruebas fueron publicados en la revista especializada Medicina.
Dicho estudio clínico de Fase 2/3 busca demostrar la seguridad y eficacia del suero hiperinmune en términos de mejoría clínica del paciente: la recuperación pronta para poder ser externado, que no avance la enfermedad y por tanto la necesidad de asistencia respiratoria mecánica o el traslado a una unidad de cuidado intensivo.
“El ensayo clínico evaluará si los anticuerpos del suero anti-COVID-19 pueden frenar la propagación del virus en el organismo y así evitar que el cuadro se agrave. Esperamos demostrar su eficacia y debemos hacerlo, como en todas las terapias experimentales, con un estudio clínico riguroso y controlado”, señaló el Dr. Fernando Goldbaum, director científico de Inmunova e investigador superior del CONICET. “Si bien las vacunas son la estrategia ideal, la pandemia plantea la necesidad de terapias efectivas en plazos más próximos que permitan disminuir el impacto del nuevo coronavirus. Nuestro suero no necesita de donantes, se puede producir en grandes cantidades y se puede suministrar a cada paciente en una concentración conocida de anticuerpos”, indicó Goldbaum, que también dirige el Centro de Rediseño e Ingeniería de Proteínas de la UNSAM y el Laboratorio de Inmunología y Microbiología Molecular de la Fundación Instituto Leloir.
Este suero terapéutico es una inmunoterapia basada en anticuerpos policlonales equinos, obtenidos mediante la inyección de una proteína recombinante del SARS-CoV-2 en estos animales, inocua para ellos, que hace que generen gran cantidad de anticuerpos neutralizantes.
Luego de la extracción del plasma –un proceso similar al que se utiliza cuando se extrae plasma de personas (plasmaféresis)– estos anticuerpos se purifican y procesan, a través de un proceso biotecnológico, para obtener fragmentos de los anticuerpos con alta pureza y buen perfil de seguridad.
El suero producido contiene gran cantidad de estos anticuerpos con capacidad neutralizante, es decir, que podría evitar que el virus ingrese a las células que es donde se multiplica.
Una inmunoterapia altamente escalable
El suero hiperinmune anti-COVID-19 ha sido desarrollado para inmunización pasiva, es decir, que al paciente se le administran anticuerpos contra el agente infeccioso, produciendo su bloqueo y evitando que se propague. Esta estrategia terapéutica es similar a la del plasma de personas que se recuperaron del COVID-19, pero en este caso los anticuerpos se obtienen de plasma equino. Esto posibilita que la producción del suero terapéutico a partir de este plasma pueda escalarse en cantidad.
Los anticuerpos policlonales equinos se utilizan para la elaboración de medicamentos, atender emergencias médicas como el envenenamiento por mordedura de serpientes y alacranes, intoxicaciones por toxina tetánica, botulismo, exposición al virus de la rabia y enfermedades infecciosas como la influenza aviar.
“Nuestro conocimiento previo y experiencia en la investigación de sueros hiperinmunes nos permitió avanzar en este desarrollo con la celeridad que demanda la pandemia, en un trabajo de articulación público-privada. Además contamos con el asesoramiento de un comité de expertos, que va a monitorear la seguridad y los resultados del ensayo clínico”, señaló Linus Spatz, director de Inmunova. Y afirmó: “si los resultados son los esperados, el suero hiperinmune presenta la ventaja de que puede ser producido a gran escala”.
Este posible tratamiento para hacer frente al COVID-19 es fruto del trabajo encabezado por Inmunova y el Instituto Biológico Argentino (BIOL), con la colaboración de la Administración Nacional de Laboratorios e Institutos de Salud “Dr. Carlos G. Malbrán” (ANLIS), Fundación Instituto Leloir (FIL), Mabxience, CONICET, Universidad Nacional de San Martín (UNSAM), Instituto de Virología “Dr. José M. Vanella” de la Universidad Nacional de Córdoba y Grupo Insud. Y cuenta con el apoyo de la Agencia Nacional de Promoción de la Investigación, el Desarrollo Tecnológico y la Innovación.
Retiro del mercado de cuatro lotes de Herceptin
La ANMAT informa que la firma Productos Roche S.A.Q. e I. ha iniciado el retiro voluntario del mercado de los siguientes productos:
- HERCEPTIN/TRASTUZUMAB 440 mg – Polvo liofilizado para inyectable para infusión + solvente – Certificado 48.062 – Lotes N3992B05, N3931B06, N3933B04 y N3935B01 todos con vencimiento: 08/2023.
- HERCEPTIN-PERJETA COMBOPACK / TRASTUZUMAB – PERTUZUMAB –Polvo liofilizado para inyectable para infusión + solvente + concentrado en solución para infusión – Presentación combinada, multiempaque conteniendo 3 frascos ampolla de: TRASTUZUMAB 440 mg + solvente x 21 ml + PERTUZUMAB 420 mg/14 ml (30 mg/ml) – Certificados N° 48.062 y 57.113 – Lote: H0379B24 – vencimiento 08/2021.
La medida fue adoptada luego de que se detectara la presencia de partículas de vidrio en algunos viales del solvente de dilución que acompaña al frasco ampolla del principio activo en la presentación del producto Herceptin/Trastuzumab.
Esta Administración Nacional se encuentra realizando el seguimiento y recomienda a los profesionales que se abstengan de utilizar las unidades correspondientes a los lotes detallados.
ANMAT aprobó el primer test de diagnóstico 100% nacional
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) aprobó un test desarrollado y elaborado en Argentina basado en tecnología PCR en tiempo real (RT-PCR), es decir, el método gold standard aceptado internacionalmente para la detección y seguimiento del coronavirus SARS-CoV-2.
Su nombre es CoronARdx. Es el primer test basado en la tecnología de PCR que cumple con los estándares internacionales de Buenas Prácticas de Manufactura (GMP) y cuyos valores de performance como la sensibilidad, especificidad, reacción cruzada y reproducibilidad son comparables con los mejores del mundo.
Se realiza a partir del ARN viral extraído desde un hisopado oro/nasofaríngeo como la mayoría de los test disponibles, pero por su alta sensibilidad permite no solo determinar un resultado negativo o positivo, sino también medir el nivel de carga viral detectado.
Muchos trabajos de investigación relacionan esta medición con la capacidad de contagio, la intensidad de síntomas e incluso como control de calidad de la muestra para evitar informar falsos negativos.
Es un desarrollo nacional, producto de la asociación estratégica de la empresa Argenomics, que aportó su expertise en investigación, desarrollo e innovación de más de 15 años en diagnóstico molecular del cáncer y otras enfermedades y la start up Zev Biotech, que aportó su conocimiento en la elaboración de kits diagnósticos, más un acuerdo con la empresa Cromoion, para la producción a gran escala de los kits bajo normas GMP en una planta calificada por ANMAT.
Se espera que puedan abastecer al mercado de 80 mil test semanales, sustituir los kits actuales importados e inclusive tienen solicitudes para exportar al exterior, generándole al país un importante ahorro e ingreso de divisas. Es el primero de su clase (kit RT-PCR de origen nacional) tanto para Argentina como para Latinoamérica.
En opinión de Eduardo López, infectólogo pediatra y jefe del Departamento de Medicina del Hospital de Niños Ricardo Gutiérrez, “es una muy buena noticia disponer de un test nacional de muy alta calidad, desarrollado y fabricado íntegramente en nuestro país, lo que va a contribuir a autoabastecernos de este recurso, un tema no menor en el marco de una pandemia como la que estamos viviendo; además, tener un kit de PCR de producción nacional va a facilitar efectuar más testeos a menor costo”.
La técnica de RT-PCR es la tecnología de referencia universal (gold standard) y la elegida por el Estado argentino -a partir de kits importados adquiridos de diferentes países- para diagnosticar COVID-19 en la red de casi 340 laboratorios públicos y privados en todo el territorio. Es por lo tanto la tecnología de elección del ANLIS/Malbrán para la identificación y diagnóstico de COVID-19 por su máxima fiabilidad para detectar la presencia del virus en un tiempo estimado de 90 minutos. Los especialistas conocen cómo funciona, saben cómo interpretar la información, qué reactivos usar, los tipos de insumos necesarios y qué decisión tomar en función de los resultados del test.
Colaboraron con Argenomics y Zev Biotech en todo el proceso que va desde la idea de generar un kit diagnóstico de máximo nivel de calidad internacional hasta la presentación de los primeros test, el Ministerio de Ciencia, Tecnología e Innovación de la Nación, la Agencia de Promoción de Ciencia y Tecnología de la Nación, el Ministerio de Desarrollo Productivo Nacional, el Ministerio de Salud de la Nación, ANLIS Malbrán, el Banco Interamericano de Desarrollo (BID), el Hospital Italiano de Buenos Aires, el INBIRS (Facultad de Medicina UBA-Conicet), el Laboratorio Central de Malvinas Argentinas –Provincia de Buenos Aires-, y la Cámara Argentina de Biotecnología (CAB), entre muchos otros.
Para la aprobación del test CoronARdx, la ANMAT evaluó los resultados de más de 300 validaciones clínicas incluyendo muestras enviadas desde la Administración Nacional de Laboratorios e Institutos de Salud -Malbrán- (ANLIS), y análisis realizados directamente en el Hospital Italiano de Buenos Aires y el INBIRS (UBA-CONICET), entre otros. Esas validaciones incluyeron la comparación entre los resultados obtenidos por los test disponibles vs. el test de referencia. Telam.
Lo más visto
- Covishield, la vacuna que India lanzó con Oxford-AstraZeneca
- El gobierno establece los requisitos para la producción de cannabis medicinal
- Anmat aprobó en el país la primera vacuna que protege contra el dengue
- Comunicación de Novo Nordisk: Diferencias en la indicación de Victoza® y Saxenda®
- Ibupirac declarado apto para celíacos