Advertencia de seguridad de la FDA sobre Tofacitinib
La agencia regulatoria del medicamento de Estados Unidos agregó un recuadro de advertencia a tofacitinib de Pfizer (Xeljanz, Xeljanz, XR) debido a un mayor riesgo de coágulos sanguíneos y muerte asociados con dosis altas del medicamento, según una comunicación de seguridad.
La FDA también ha limitado el uso aprobado de tofacitinib para la colitis ulcerosa (CU) a pacientes en los que han fallado o no toleran los bloqueadores del factor de necrosis tumoral (TNF) u otros medicamentos.
Según una revisión de datos clínicos de un ensayo de seguridad, la FDA emitió previamente una advertencia que señalaba problemas de seguridad con el régimen de dosificación de 10 mg de tofacitinib 2 veces al día en pacientes con artritis reumatoide (AR). El estudio demostró un mayor riesgo de coágulos sanguíneos en los pulmones y muerte asociados con este régimen de dosificación, según un comunicado.
Aunque aprobado para el tratamiento de la CU, el régimen de dosificación de 10 mg para tofacitinib no está aprobado para su uso en la artritis reumatoide. Sin embargo, estos riesgos también pueden aplicarse a quienes toman tofacitinib para la CU, según la FDA.
Tofacitinib, que se aprobó por primera vez en 2012 para la artritis reumatoide y posteriormente se aprobó para indicaciones adicionales en la AR y la artritis psoriásica (PsA), funciona disminuyendo la actividad del sistema inmunitario. Desde su aprobación inicial, tofacitinib se ha sometido a un ensayo de seguridad posterior a la comercialización en pacientes con AR con metotrexato de fondo. El ensayo está estudiando tanto dosis de 5 mg dos veces al día de tofacitinib como dosis de 10 mg dos veces al día en comparación con un bloqueador del TNF.
Según la FDA, los resultados provisionales mostraron:
Diecinueve casos de coágulos de sangre en el pulmón de 3884 pacientes-años de seguimiento en pacientes que recibieron tofacitinib 10 mg dos veces al día, en comparación con 3 casos de 3982 pacientes-años de seguimiento en pacientes que recibieron bloqueadores de TNF.
Cuarenta y cinco casos de muerte por todas las causas de 3884 pacientes-años de seguimiento en pacientes que recibieron tofacitinib 10 mg dos veces al día, en comparación con 25 casos de 3982 pacientes años en pacientes que recibieron bloqueadores del TNF.
Debido a los riesgos, la FDA dijo que los profesionales de la salud deberían suspender el tratamiento con tofacitnib y evaluar rápidamente a los pacientes con síntomas de trombosis.
Si se usa en el tratamiento de la CU, los pacientes solo deben tomar la dosis efectiva más baja y la dosis de 10 mg dos veces al día debe limitarse a la menor duración necesaria, según la FDA.
Referencia
FDA approves Boxed Warning about increased risk of blood clots and death with higher dose of arthritis and ulcerative colitis medicine tofacitinib (Xeljanz, Xeljanz XR) [FDA Drug Safety Communication]. FDA. https://www.fda.gov/drugs/drug-safety-and-availability/fda-approves-boxed-warning-about-increased-risk-blood-clots-and-death-higher-dose-arthritis-and.
Primer tratamiento para la hipoglucemia grave sin inyección
La Administración de Drogas y Alimentos de EE.UU. (FDA) aprobó el 24 de julio el polvo nasal de Baqsimi, la primera terapia con glucagón aprobada para el tratamiento de emergencia de la hipoglucemia grave.
La hipoglucemia grave se produce cuando los niveles de azúcar en la sangre caen a un nivel en el que el paciente se siente confundido, pierde la conciencia o sufre otros síntomas que requieren la asistencia de otra persona para su tratamiento. Por lo general, la hipoglucemia grave ocurre en personas con diabetes que están usando tratamiento con insulina. Baqsimi está aprobado para tratar la hipoglucemia grave en pacientes con diabetes a partir de los cuatro años.
“Hay muchos productos en el mercado para quienes necesitan insulina, pero hasta ahora, las personas que sufrían un episodio de hipoglucemia severa tenían que ser tratadas con una inyección de glucagón que primero tenía que mezclarse en un proceso de varios pasos”, explicó Janet Woodcock. MD, directora del Centro de Evaluación e Investigación de Medicamentos de la FDA. “Esta nueva forma de administrar glucagón puede simplificar el proceso, que puede ser crítico durante un episodio, especialmente porque el paciente puede haber perdido el conocimiento o puede tener una convulsión. En esas situaciones, queremos que el proceso para tratar a la persona sea lo más simple posible “.
Baqsimi, que es un polvo administrado en la nariz, vendrá en un dispensador de un solo uso.
Baqsimi aumenta los niveles de azúcar en sangre al estimular al hígado a liberar la glucosa almacenada en el torrente sanguíneo. Tiene el efecto opuesto de la insulina, que reduce los niveles de azúcar en la sangre.
La eficacia y seguridad del glucagón en polvo nasal de Baqsimi para tratar la hipoglucemia grave se evaluó en dos estudios de 83 y 70 adultos con diabetes, que compararon una dosis única de Baqsimi con una dosis única de la inyección de glucagón para dar una respuesta de azúcar en la sangre a la hipoglucemia inducida por insulina. Baqsimi aumentó adecuadamente los niveles de azúcar en la sangre. En un estudio pediátrico de 48 pacientes mayores de cuatro años con diabetes tipo 1, se observaron resultados similares.
Baqsimi no debe ser utilizado por pacientes con feocromocitoma, un tumor raro de tejido de las glándulas suprarrenales, ni en pacientes con insulinoma, un tumor del páncreas. Baqsimi no debe ser usado por pacientes con hipersensibilidad conocida al glucagón o los ingredientes inactivos que se encuentran en el producto, ya que pueden ocurrir reacciones alérgicas.
También se advierte que debe ser usado con precaución por aquellas personas que han estado en ayunas durante largos períodos de tiempo, tienen insuficiencia suprarrenal o hipoglucemia crónica debido a que estas afecciones producen niveles bajos de glucosa liberable en el hígado. Las reacciones adversas más comunes asociadas con Baqsimi son náuseas, vómitos, dolor de cabeza, irritación del tracto respiratorio superior, ojos llorosos, enrojecimiento de los ojos y picazón. Los efectos secundarios de Baqsimi son similares al glucagón inyectable, con la adición de síntomas nasales y relacionados con los ojos, como ojos llorosos y congestión nasal, debido a la forma en que se administra el medicamento.
La FDA otorgó la aprobación de Baqsimi a Eli Lilly.
Mejoras en la vida de transplantados
En el mes del aniversario de la aprobación de la Ley Justina, Astellas y Gador, su distribuidor local autorizado, celebran el trabajo conjunto realizado durante este tiempo entre todos los expertos del sector para ofrecer soluciones a los pacientes que necesitan trasplantes en Argentina.
Actualmente en el país, más de 7.300 pacientes están en la lista de espera de órganos según el Instituto Nacional Central Único Coordinador de Ablación e Implante (INCUCAI).
Aunque en lo que va de 2019 se han visto números positivos, con más de 1.020 trasplantes realizados hasta la fecha y más de 480 donantes reales registrados, hay retos por delante y Astellas junto a Gador siguen comprometidos por ayudar a los pacientes trasplantados.
“Uno de los principales retos es el sistema de obtención de órganos”, explicó Livia Medina, Directora Senior de Negocios Internacionales de Astellas Pharma. “La industria necesita encontrar formas de trabajar con los grupos de interés para contratar más personal y ofrecer más recursos que ayuden a mejorar el sistema para todos los pacientes de trasplantes. Estamos comprometidos para trabajar junto con la industria a fin de explorar alternativas y ofrecer mejores soluciones a los pacientes”.
Astellas dedica gran parte de su inversión a la investigación y desarrollo (I+D) para identificar terapias que ayuden a tratar las necesidades de los pacientes que no hayan sido satisfechas. En el año fiscal 2018, Astellas invirtió USD 1.900 millones a nivel global en I+D, lo cual representa casi el 17% de sus ingresos totales reinvertidos para buscar mejores alternativas terapéuticas para los pacientes. Esto permite a la compañía mantener el foco en la innovación como parte fundamental de sus actividades para seguir trabajando por y fuertemente comprometidos con los pacientes.
Además, Astellas, de la mano de Gador, apoya a instituciones y organizaciones dedicadas a acompañar al paciente trasplantado y a su familia. Éstas son algunas de sus acciones más recientes:
- La colaboración con la Asociación de Deportistas Trasplantados en la organización de los Juegos Mundiales para deportistas trasplantados, que se realizará en Newcastle, del 17 al 24 de agosto.
- El apoyo a Organizaciones No Gubernamentales como APAT (Asociación Argentina para el Trasplante) para que puedan acompañar a los pacientes y asesorarlos sobre temas de su problemática diaria, en materia de derechos del paciente o apoyo en las mejoras del sistema de donaciones, entre otros.
- La difusión de información relevante sobre trasplantes a la comunidad de pacientes y la importancia de la donación de órganos, en conjunto con Gador.
Estos son solo algunos ejemplos de los esfuerzos de Astellas y Gador en una de las áreas que las dos compañías consideran muy importantes. Brindar apoyo continuo a los pacientes trasplantados argentinos y sus familias es uno de los objetivos de esta alianza, que trabaja para desarrollar soluciones innovadoras y confiables, además de fortalecer el acceso de los pacientes.
Descubren mecanismo para tratar infecciones crónicas
Investigadores del Vlaams Instituut voor Biotechnologie en Gante (Bélgica) descubrieron, en un estudio publicado en la revista ‘Molecular Cell’, el mecanismo para despertar a bacterias ‘durmientes’ y, de esta forma, combatir infecciones crónicas.
Estas bacterias se llaman ‘persistentes’ y se pueden encontrar en cada tipo de población bacteriana estudiada hasta ahora, incluidos los patógenos humanos importantes, y suelen ser insensibles a los antibióticos.
De hecho, pueden despertarse espontáneamente y colonizar al húesped, lo que lleva a un nuevo brote de la infección. Hasta ahora, se desconocía cómo estas células podían volver del estado latente al estado activo, si bien el nuevo estudio ha proporcionado información sobre cómo se despiertan. Para ello, utilizaron un sistema modelo de ‘E. coli’ basado en ‘HokB’, un péptido que se sabe que promueve el desarrollo de células persistentes formando poros en la membrana de la célula bacteriana. Esto provoca una rápida pérdida de energía, empujando a las bacterias a un estado de baja energía o sueño profundo.
Esta formación de poros sólo es posible cuando dos péptidos HokB están unidos entre sí. El despertar de estas bacterias durmientes es posible solo cuando se rompe el enlace entre los péptidos y, a su vez, el poro. De hecho, solo cuando el poro se degrada, las células pueden energizarse nuevamente al consumir los nutrientes disponibles.
Las células persistentes son responsables de las infecciones crónicas como, por ejemplo, las del tracto urinario por ‘Escherichia coli’, las infecciones pulmonares en pacientes con fibrosis quística por ‘Pseudomonas aeruginosa’, o la tuberculosis por ‘Mycobacterium tuberculosis’.
“Los resultados de este trabajo pueden ayudarnos a descubrir nuevas moléculas y diseñar nuevas estrategias para erradicar a los persistentes. Las combinaciones de moléculas que estimulan el despertar junto con los antibióticos clásicos podrían erradicar las infecciones crónicas”.
Fuente: Europa Press / COFA
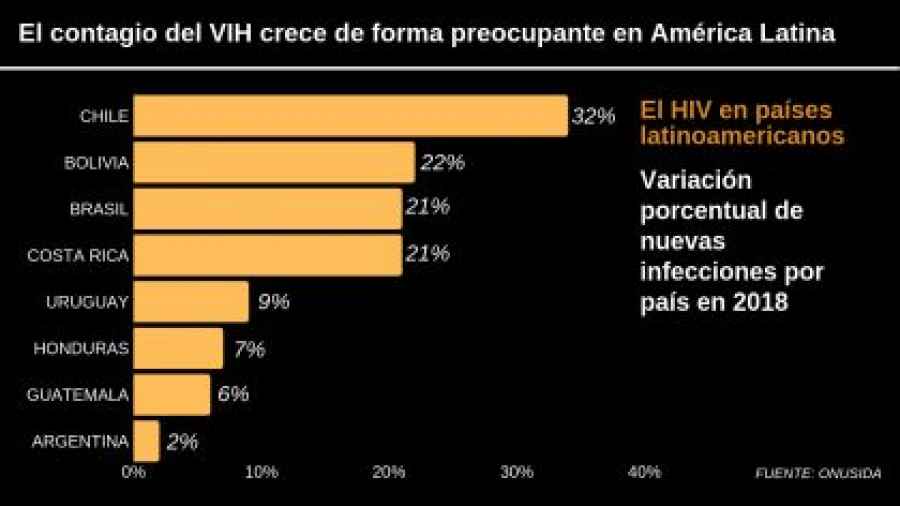
El contagio del VIH crece de forma preocupante en América Latina
América Latina presentó un 7% de aumento en la tasa de contagio del virus del Sida, VIH, entre los años de 2010 y 2018, reveló el último informe del Programa Conjunto de las Naciones Unidas sobre el VIH/sida, publicado este 16 de julio.
Según el informe, solamente en el año 2018 casi 100.000 personas contrajeron el virus en América Latina, correspondiendo más de la mitad de ellas a Brasil, el país más poblado. El continente que entre 2005 y 2013 registró un descenso del 3% en el número de contagio, ahora es una de las zonas a vigilar para los años siguientes.
Aunque Brasil sufrió incremento de 21% desde el 2010, le sigue muy de cerca Chile, con un alarmante aumento del 34% en los nuevos contagios, mientras Bolivia 22% y Costa Rica 21% en el mismo período. Argentina, Guatemala, Honduras y Uruguay observaron aumentos, pero menores que un 10%. México fue el único país que se mantuvo estable a lo largo de los años y no vio ni un aumento ni un descenso en el contagio del VIH.
El 2018, cerca de 35.000 personas murieron en América Latina a causa del sida, lo que equivale a un 4,5% de las muertes por la infección en todo el mundo.
El Salvador, por ejemplo, logró reducir prácticamente a la mitad (48%) los casos de nuevos contagios en el país. Nicaragua logró disminuirlos en un 29%, Colombia en un 22%, Ecuador en un 12% y Paraguay en un 11%. Panamá y Perú también lograron mejorar sus números en un 8% y un 6% respectivamente.
“En 2017 se informó de Onusida que había 67.000 personas viviendo con VIH, este año nos están reportando que hay 71.000 personas viviendo con VIH (datos de 2018), es decir el último informe dice que hay entre 4.000 y 5.000 personas más que están viviendo con VIH”, indicó la subsecretaria de Salud Pública de Chile, Paula Daza. De las 71.000 personas en Chile viviendo con VIH “hay un 87% que conocen el estado y de ellas hay un 73% que están en tratamiento, hay 45.140 personas en tratamiento”, agregó.
En diciembre de 2018, el Programa Conjunto de las Naciones Unidas sobre el VIH/Sida ya había revelado preocupantes cifras para Chile: es uno de los 10 países del mundo que registraron aumentos de 50% o más en nuevos casos de la enfermedad en su población entre 2010 y 2017. Este dato generó críticas a las políticas públicas implementadas por el Gobierno para controlar el virus en el país, y derivó en la renuncia de la jefa del Departamento de VIH del Ministerio de Salud, Ana María San Martín.
Actualmente viven en nuestro planeta 37,9 millones de personas infectadas por el VIH, de ellas 1,9 millones residen en América Latina.
A nivel mundial, las muertes asociadas al sida bajaron en 2018 un tercio respecto a 2010, cayendo a 770.000, un tercio menos que en 2010, agregó ONUSida, aunque advirtió que los esfuerzos mundiales para erradicar la enfermedad están estancados debido a la reducción de la financiación. Más de tres de cada cinco seropositivos en el mundo -23,3 millones de 37,9- reciben tratamientos antirretrovirales, una proporción récord.
Estos tratamientos, que permiten no transmitir el virus del sida si se toman correctamente, llegan a diez veces más enfermos que a mediados de los años 2000.
La cifra de muertes del año pasado es algo inferior a la de 2017 (800.000) y un tercio menor que la 2010 (1,2 millones). Y está muy por debajo de la hecatombe registrada en 2004, cuando el virus del sida se cobró la vida de 1,7 millones de personas. El número de nuevas infecciones se mantiene estable respecto a los años precedentes (1,7 millones).
En América Latina, la tasa de nuevos contagios del virus del sida creció 7%. Proporcionalmente, Chile es, con 34%, el país de la región donde más aumentaron los casos, seguido por Bolivia (22%), Brasil y Costa Rica (21%).
Estas cifras globales esconden no obstante grandes diferencias regionales, destaca Onusida, que advierte que la lucha contra la enfermedad no avanza a ritmo suficiente. En general, la caída del número de muertes y el mejor acceso a los tratamientos se explican por los avances realizados en el sur y el este de África, el continente más afectado por el sida.
En otras partes del mundo, algunos indicadores son preocupantes. En Europa del este y en el centro de Asia, el número de nuevas infecciones se disparó 29% desde 2010. También, el número de fallecimientos aumentó 5% en estas regiones y 9% en Oriente Medio y el norte de África en estos últimos ocho años.
Financiación a la baja
Onusida advirtió sin embargo en su informe que la financiación para eliminar esta enfermedad está reduciéndose: “Por primera vez desde el 2000, los recursos disponibles para la lucha global contra el sida bajaron”, alertó Gunilla Carlsson, responsable de Onusida, quien detalló que en 2018, 19.000 millones de dólares se dedicaron a programas de lucha contra el sida, 1.000 millones menos que en 2017 y 7.000 menos que la suma que se considera necesaria para 2020 (26.200).
“Esta reducción es un fracaso colectivo”, considera Onusida, que afirma que concierne “a todas las fuentes de financiación”: contribuciones internacionales de los Estados, inversiones de los países o donaciones privadas con fines filantrópicos. Por ello 2019 es un año crucial. Organizada cada tres años, la conferencia de financiación del Fondo Mundial se celebrará el 10 de octubre en la ciudad francesa de Lyon. El objetivo es conseguir 14.000 millones de dólares para el período 2020-22 para poder financiar este fondo.
“Necesitamos con urgencia aumentar el liderazgo político para poner fin a la epidemia”, subrayó Carlsson. “Hay que invertir de modo inteligente, mirando también a los países que están obteniendo los mayores éxitos en este campo. Derrotar al sida es posible si nos concentramos en las personas, no en la enfermedad, creando hojas de rota para los pacientes y las áreas que quedaron atrás, y adoptando un enfoque basado en los derechos humanos para llegar a las personas más afectadas”, agregó.
Fuente: Consenso Salud
Nuevo antibiótico para infecciones graves del tracto urinario e infecciones intraabdominales
La Administración de Drogas y Alimentos de los Estados Unidos aprobó Recarbrio (imipenem, cilastatina y relebactam), un medicamento antibacteriano para tratar a adultos con infecciones complicadas del tracto urinario (ICTU) e infecciones intraabdominales complicadas (IIC).
Es una inyección combinada de tres medicamentos que contiene imipenem-cilastatina, un antibiótico previamente aprobado por la FDA, y relebactam, un nuevo inhibidor de la beta-lactamasa.
“Es importante que el uso de Recarbrio se reserve para situaciones en las que existen medicamentos antibacterianos alternativos o ninguno para el tratamiento de la infección de un paciente”, destacó Ed Cox, MD, MPH, director de la Oficina de Productos Antimicrobianos en el Centro de Evaluación e Investigación de Medicamentos de la FDA.
La determinación de la eficacia del medicamento fue apoyada en parte por los hallazgos de la eficacia y seguridad de imipenem-cilastatina para el tratamiento de ICTU e IIC.
La contribución de relebactam a Recarbrio se evaluó en base a datos de estudios in vitro y modelos animales de infección. La seguridad de Recarbrio, administrada por inyección, se estudió en dos ensayos, uno para ICTU e IIC. El ensayo ICTU incluyó 298 pacientes adultos con 99 tratados con la dosis propuesta de Recarbrio. El ensayo IIC incluyó a 347 pacientes con 117 tratados con la dosis propuesta.
Las reacciones adversas más comunes observadas en pacientes tratados con Recarbrio incluyeron náuseas, diarrea, cefalea, fiebre y aumento de las enzimas hepáticas.
Recarbrio no debe usarse en pacientes que toman ganciclovir a menos que los beneficios superen los riesgos, ya que se han informado convulsiones generalizadas. Los pacientes también deben evitar el uso de este antibiótico cuando toman ácido valproico o divalproex sódico, medicamentos utilizados para controlar las convulsiones, ya que una reducción en el nivel de ácido valproico puede provocar convulsiones.
Recarbrio recibió la designación de Producto de Enfermedades Infecciosas Calificadas (QIDP) de la FDA. La designación QIDP se otorga a los medicamentos antibacterianos y antimicóticos destinados a tratar infecciones graves o que ponen en peligro la vida bajo el título Generar Incentivos de Antibióticos Ahora (GAIN) de la Ley de Seguridad e Innovación de la FDA. Como parte de la designación QIDP, Recarbrio recibió la Revisión prioritaria en virtud de la cual el objetivo de la FDA es tomar medidas en una solicitud dentro de un plazo acelerado.
La FDA otorgó la aprobación a Merck & Co., Inc.
Se aprobó el Vademécum de Drogas Oncológicas
RESOL-2019-1089-APN-SGS#MSYDS
Ciudad de Buenos Aires, 15/07/2019
Que mediante el Decreto Nº 174/2018 se aprobó el Organigrama de Aplicación a la Administración Nacional centralizada hasta el nivel de Subsecretaría a fin de establecer una nueva estructura organizacional que permita el cumplimiento de los objetivos de Gobierno.
Que mediante la Decisión Administrativa Nº 307/18 se aprobó la estructura organizativa de primer y segundo nivel operativo del entonces MINISTERIO DE SALUD y se facultó a su titular a modificar la estructura aprobada, sin que ello implique incremento de las unidades organizativas que la componen.
Que por Anexos III y IV de la mencionada Decisión Administrativa, se delimitaron las funciones de la entonces COORDINACIÓN DE BANCO DE DROGAS dependiente de la DIRECCIÓN NACIONAL DE MEDICAMENTOS Y TECNOLOGÍA SANITARIA, bajo la órbita de la SUBSECRETARÍA DE PROGRAMACIÓN TÉCNICA Y LOGÍSTICA de la SECRETARÍA DE COBERTURAS Y RECURSOS DE SALUD.
Que por Decreto Nº 801/18 se modificó la Ley de Ministerios N° 22.520, creándose el MINISTERIO DE SALUD Y DESARROLLO SOCIAL, determinándose sus competencias.
Que mediante el Decreto Nº 802/2018 se creó el cargo de SECRETARIO DE GOBIERNO DE SALUD con dependencia del MINISTERIO DE SALUD Y DESARROLLO SOCIAL.
Que por Artículo 6 del Decreto Nº 958/2018 se modificó el Anexo I – Organigrama de Aplicación de la Administración Nacional centralizada-, aprobado por el artículo 1º del Decreto Nº 174/18 y sus modificatorios, el Apartado XVII, correspondiente al MINISTERIO DE SALUD Y DESARROLLO SOCIAL.
Que por Resolución RESOL-2019-405-APN-MSYDS Se sustituyó la denominación “COORDINACIÓN DE BANCO DE DROGAS” por “COORDINACIÓN DE BANCO DE DROGAS ESPECIALES” y se aprobó su organigrama.
Que por la aludida Resolución también se Instruyó a la DIRECCIÓN NACIONAL DE MEDICAMENTOS Y TECNOLOGÍA SANITARIA a implementar las medidas necesarias para trabajar, en el plazo de SESENTA (60) días contados a partir del dictado de dicha resolución, en la ampliación del Vademécum respecto de las drogas oncológicas, la cual quedará supeditada a aprobación del Secretario de Gobierno de Salud.
Que a efectos de contribuir a una eficiente integración del Sistema Sanitario Nacional y a promover a su acceso equitativo la COORDINACIÓN DE BANCO DE DROGAS auxilia a las jurisdicciones con la estricta finalidad de equiparar los estándares de asistencia sanitaria en todo el territorio nacional.
Que de la lectura de los obrados se evidencia que la DIRECCIÓN NACIONAL DE MEDICAMENTOS Y TECNOLOGÍA SANITARIA dio integro cumplimiento a lo estipulado en la Resolución RESOL-2019-405-APN-MSYDS, habiendo elaborado el pertinente proyecto de Vademécum de drogas oncológicas, en concordancia con las recomendaciones efectuadas por el INSTITUTO NACIONAL DEL CANCER en su carácter de organismo referente en materia de Cáncer en la República Argentina.
Que este entendimiento, resulta conveniente aprobar el proyecto de VADEMÉCUM DE DROGAS ONCOLÓGICAS con su respectivo MODULO DE INDICACIONES VADEMÉCUM, a fin de propiciar una más eficiente cobertura sanitaria a través de la COORDINACIÓN DE BANCO DE DROGAS ESPECIALES.
Que la SUBSECRETARÍA DE PROGRAMACIÓN TÉCNICA Y LOGÍSTICA y la SECRETARÍA DE COBERTURAS Y RECURSOS DE SALUD de la SECRETARÍA DE GOBIERNO DE SALUD han tomado intervención en el marco de sus competencias.
Que la DIRECCIÓN DE ASUNTOS LEGALES de la SECRETARIA DE GOBIERNO DE SALUD del MINISTERIO DE SALUD Y DESARROLLO SOCIAL ha tomado su intervención de su competencia.
Que la presente se dicta en ejercicio de la competencia atribuida por la Ley de Ministerios Nº 22.520 y sus normas modificatorias y complementarias; Decreto Nº 174/2018 y sus normas modificatorias y complementarias; Ley de Firma Digital Nº 25.506 y sus normas modificatorias y complementarias; Decreto Nº 434/2016 y sus normas complementarías; Decreto Nº 561/2016 y sus normas complementarias; y los Decretos Nº 801, Nº 802 ambos del año 2018.
Por ello,
EL SECRETARIO DE GOBIERNO DE SALUD
RESUELVE:
ARTÍCULO 1º.- Apruébese el VADEMÉCUM DE DROGAS ONCOLÓGICAS de la COORDINACIÓN DE BANCO DE DROGAS ESPECIALES de acuerdo al Anexo I (IF-2019-22591574-APNDNMYTS#MSYDS) y su respectivo MODULO DE INDICACIONES DE VADEMÉCUM de acuerdo al Anexo II (IF-2019-22593042-APN-DNMYTS#MSYDS), que forma parte integrante de la presente medida.
ARTÍCULO 2º.- Regístrese, comuníquese, publíquese, dese a la Dirección Nacional de Registro Oficial y archívese. Adolfo Luis Rubinstein
NOTA: El/los Anexo/s que integra/n este(a) Resolución se publican en la edición web del BORA -www.boletinoficial.gob.ar-
e. 16/07/2019 N° 50844/19 v. 16/07/2019
Fecha de publicación 16/07/2019
Nueva app de Philips para embarazo
Royal Philips, líder mundial en tecnología de la salud, presentó Embarazo+ en Argentina, una de las aplicaciones móviles relacionadas con paternidad más descargadas del mundo, que guía a los futuros padres durante el embarazo y crianza: imágenes a color y ecografías, registro de peso, contador de contracciones, guía del tamaño del bebé y registro de citas médicas, entre otras facilidades.
En una era de personalización, esta app pone a las personas al centro y las motiva a tener un rol más activo en su propia salud para mantenerse saludables.
Embarazo+ está completamente diseñada para ayudar a los padres a llevar adelante un embarazo saludable en todas sus etapas. La app permite seguir el crecimiento con imágenes fetales en 3D durante el tiempo de gestación (y animaciones activadas por el tacto), audio completo (incluido latido del corazón SFX) e información específica en relación con el desarrollo del bebé.
Además, la app permite compartir la información con familiares y profesionales, a la vez que funciona como una plataforma de artículos creados por un panel de expertos en lactancia materna y psicología del desarrollo. Embarazo+ puede ser configurada para papás, abuelos y otros familiares y amigos. A la fecha en Latinoamérica tiene un registro de usuarios activos de 800 mil personas al mes.
Con el objetivo de mejorar la salud de las personas, especialmente de la mujer y el recién nacido, Philips desarrolla innovadores productos como Embarazo+ que, con más de 4,7 millones de descargas desde su lanzamiento en Latinoamérica, proporciona comentarios y consejos personalizados a los padres.
Así, desde el momento en que los futuros padres se enteran de que están esperando un bebé, Philips está con ellos ofreciéndoles asesoramiento y apoyo durante los primeros 1.000 días con Embarazo+, entre tantas otras tecnologías destinadas a cumplir con el objetivo de la compañía: mejorar la vida de 3 mil millones de personas para el año 2030. La app está
disponible en el Apple App Store y en Google Play.
Investigación de fármacos orales para migrañas
Dos nuevos grupos de medicamentos orales se están investigando para unirse en el corto-medio plazo al arsenal de antimigrañosos para el tratamiento agudo de las crisis. Rimegepant y ubrogepant, antagonistas del receptor del péptido relacionado con el gen de la calcitonina (CGRP) o gepantes, y lasmiditan, un agonista del receptor de la serotonina 5-HT1F, han finalizado los ensayos de fase III.
Se espera, por tanto, que en breve tomen el relevo de los triptanes, treinta años más tarde de la llegada de estos medicamentos a la clínica, según una revisión sobre los avances en cefaleas aparecida en la revista Neurology.
El mecanismo de acción de los gepantes es muy diferente a los triptanes, explica el neurólogo Samuel Díaz Insa, de la Unidad de Cefaleas del Servicio de Neurología del Hospital La Fe, de Valencia. “Actúan bloqueando o antagonizando el receptor postsináptico de CGRP”, afirma. Este péptido, “que se libera como vasodilatador y proinflamatorio, tiene gran importancia en la génesis y mantenimiento de las crisis”.
Toxicidad hepática
Los gepantes no tienen un efecto vasoconstrictor. Se ha investigado con seis de ellos y todos han demostrado eficacia en la fase aguda, pero su asociación con problemas de toxicidad hepática llevó a paralizar el desarrollo de dos de ellos.
La revisión apunta que parece que en realidad esta toxicidad tuvo que ver con los metabolitos de los fármacos y no con su mecanismo de acción sobre el CGRP. Sin embargo, “queda la duda razonable de qué puede ocurrir con un teórico abuso de gepantes”, observa Sonia Santos, coordinadora del Grupo de Cefaleas de la Sociedad Española de Neurología (SEN).
Rimegepant y ubrogepant, han demostrado eficacia en parámetros primarios como estar libre de dolor durante dos horas y frente a la fotofobia en un grado similar a los triptanes.
El porcentaje de pacientes beneficiados se reduce al 20%, mientras que con triptanes y ditanes asciende a un 33%.
Un punto fuerte es su perfil de tolerabilidad. Se asocian en un porcentaje poco mayor que el placebo con náuseas y somnolencia, pero hasta la fecha no se han cumplido los peores temores de que pudieran incrementar la morbilidad cardio y cerebrovascular o las enzimas hepáticas.
Tratamiento preventivo
Por otra parte, cabe recordar que el CGRP es también la diana de los anticuerpos monoclonales que se han desarrollado para la prevención de la migraña (ver información de salida). En este sentido, una hipótesis es que un potencial uso excesivo de gepantes en pacientes con crisis frecuentes podría, en última instancia, reducir la aparición de nuevas crisis. De hecho, la portavoz de la SEN añade que el gepante atogepant ha demostrado ser eficaz en la prevención de la migraña episódica, y anuncia que está a punto de comenzar un estudio de fase III en la prevención de la migraña crónica.
La otra nueva alternativa a triptanes y gepantes es lasmiditan, que encabeza el grupo de ditanes, fármacos no tan distintos a los triptanes pero con un mecanismo de acción más dirigido y por tanto un mejor perfil de seguridad. Así, el coordinador de la Unidad de Cefaleas del Hospital Fundación Jiménez Díaz, de Madrid, Jaime Rodríguez Vico, aclara que, a grandes rasgos, los triptanes actúan como agonistas de los receptores 5-HT1B, 5-HT1D y 5-HT1F, mientras que los ditanes solo actúan como agonistas en los 5-HT1F. Al no intervenir sobre el 5-HT1B, “no tienen el efecto vasoconstrictor de los triptanes y pueden utilizarse con seguridad en pacientes con enfermedad cerebro y cardiovascular y crisis hipertensivas, en los que los triptanes están contraindicados”.
Triptanes y AINE
Con todo, el especialista asegura que los triptanes “en general son bien tolerados y eficaces”. El riesgo percibido “no es real y en parte se deriva de su mal uso y de sus predecesores, los ergóticos”. Para Rodríguez Vico, el escaso conocimiento que existe sobre estos fármacos alcanza a los prescriptores, “que en lugar de utilizar medicamentos específicos como los triptanes, recurren a derivados mórficos, como tramadol o codeína, que solo sirven para empeorar las migrañas a medio plazo”.
Las guías aconsejan en la terapia aguda de las crisis leves-moderadas de la migraña los AINE a dosis altas y los triptanes en las moderadas-severas. En ambos casos se puede recurrir al otro grupo terapéutico como rescate y en los pacientes con crisis de inicio severo se pueden indicar ambas terapias de forma concomitante, advierte Díaz Insa.
Santos agrega que la eficacia de los ergóticos se sitúa entre AINE y triptanes. “Se consideran tratamiento no específico, son agonistas no selectivos de los receptores 5HT1B/1D y por ello producen una vasoconstricción no selectiva, más intensa y duradera que la de los triptanes, con componente sistémico, que limita su uso de forma generalizada”.
Además, alerta la experta, “interactúan con otros muchos receptores como los 5HT1A, 5HT2, 5HT5 y 5HT7, lo que explica sus efectos secundarios”.
Biológicos comparten el CGRP como diana en la prevención
El péptido relacionado con el gen de la calcitonina (CGRP) es también la diana de los anticuerpos monoclonales antimigrañosos que se han desarrollado contra su ligando y contra su receptor. Son cuatro y tres de ellos ya tienen el visto bueno de las agencias, erenumab, fremanezumab y galcanezumab, a los que se espera que se una eptinezumab. “Todos han demostrado ser eficaces frente a placebo en la prevención de la migraña, tanto episódica como crónica”, destaca Sonia Santos, de la Sociedad Española de Neurología.
Estos biológicos exhiben una buena tolerabilidad y adherencia, al contrario que los fármacos orales disponibles para la prevención de la migraña, explica Jaime Rodríguez Vico, coordinador de la Unidad de Cefaleas del Hospital Fundación Jiménez Díaz, de Madrid.
También eficacia, “demostrada en ensayos a doble ciego aleatorizados”, y seguridad, “con apenas diferencias con el placebo”. Dada la rapidez de su efecto, el experto señala que se plantea en algunos casos utilizarlos como tratamiento sintomático.
Fuente: Correo Farmacéutico – España. COFA
Beca de pasantía para farmacéuticas en Hospital de Estados Unidos
Pharmabridge ofrece una beca de pasantía para farmacéuticas de las Américas ofrecida por la Dra. Olga de Torres, Farmacéutica Clínica en el Palomar Medical Center en California, Estados Unidos.
La beca está dirigida a farmacéuticas que trabajen en farmacia hospitalaria y estén interesadas en profundizar sus conocimientos en el tema antimicrobianos y enfermedades infecciosas.
Pharmabridge otorga quinientos euros para gastos y la Dra. De Torres ofrece una habitación para huéspedes en su casa para alojar a la becaria. El viaje y otros gastos adicionales corren por parte de la candidata.
Las interesadas deben contactarse con el Foro Farmacéutico de las Américas (Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.) para solicitar una carta de presentación y luego comunicar su postulación a la Dra. Agathe Wehrli, coordinadora del programa Pharamabrige, mediante correo electrónico en inglés a la dirección Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
Pharmabridge es una iniciativa voluntaria dirigida a fortalecer los servicios de farmacia y la educación farmacéutica en países de bajos ingresos y emergentes. Fundada en 1999, cuenta con el respaldo de la Federación Farmacéutica Internacional (FIP), para fomentar la comunicación y el intercambio de información, recursos y experiencias entre farmacéuticos, científicos farmacéuticos y educadores farmacéuticos de todos los rincones del mundo, lo que lleva a mejores servicios de Farmacia, mejor atención al paciente y mejor salud de la comunidad. Pharmabridge forma parte de la Junta de Prácticas de Farmacia de la FIP, trabaja en conjunto con las Secciones de la FIP y es complementaria de la FIPEd, que reúne todas las actividades educativas de la FIP.
Lo más visto
- Covishield, la vacuna que India lanzó con Oxford-AstraZeneca
- El gobierno establece los requisitos para la producción de cannabis medicinal
- Anmat aprobó en el país la primera vacuna que protege contra el dengue
- Comunicación de Novo Nordisk: Diferencias en la indicación de Victoza® y Saxenda®
- Ibupirac declarado apto para celíacos