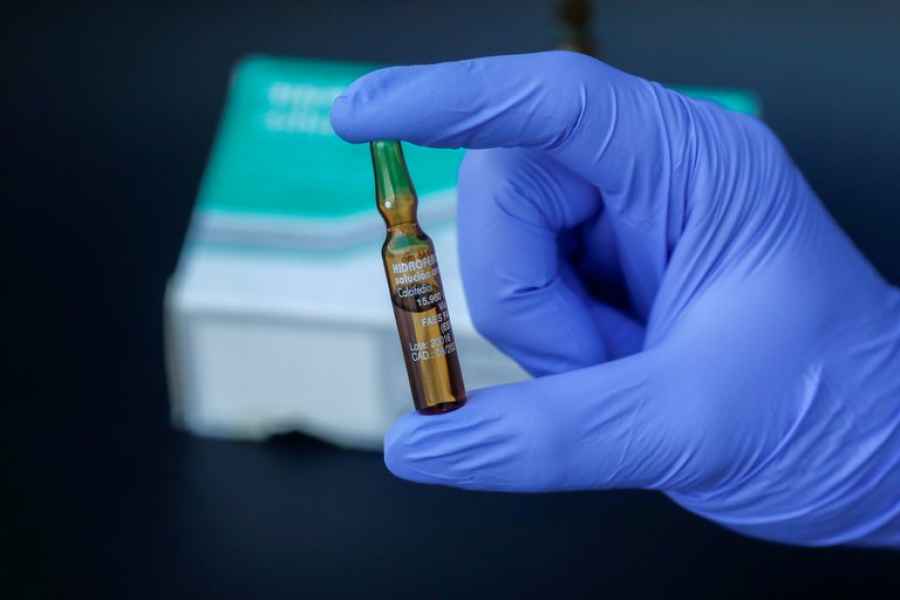
ANMAT aprobó la venta en farmacias de un test rápido de Covid-19
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) autorizó la venta en farmacias de un test rápido de coronavirus.
El producto en cuestión es de origen chino, se conoce como Immunobio, y su desarrollo estuvo en manos del laboratorio Hangzhou Immuno Biotech CO Ltd. Es importante mencionar que se trata del único autorizado por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) para su venta en farmacias.
El test rápido de coronavirus permite conocer el resultado en aproximadamente 10 minutos. Ese resultado tiene una efectividad del 96,8%. De todas maneras, es muy importante estar atentos a la advertencia que el propio envase brinda.
Allí se aclara que en caso de dar negativo esto no descarta una posible presencia del virus en la persona testeada. “Los resultados negativos no descartan infección por Covid-19”, dice.
Es importante tener en cuenta que el test rápido no es para que las personas vayan por su cuenta, lo compren y lo hagan en sus casas. Se trata de una prueba que, si bien está autorizada a venderse en farmacias, es de uso profesional exclusivo. Esto significa que debe ser un profesional de la salud quien realice el test a la persona que crea tener coronavirus o que necesite saber su estado de salud.
Se trata de un test de antígeno que se hace a través de un hisopado “para la detección cualitativa de antígenos del nuevo coronavirus SARS-CoV2 utilizando secreciones de garganta humana y secreciones nasales. El mismo está compuesto por una bolsa de aluminio con cassete de prueba y desecante, tampón de ensayo (buffer), hisopo estéril y tubo de recolección de muestras e instrucciones de uso”.
Nuevo tratamiento para el HIV aprobado por ANMAT
La idea surgió en Argentina y fue llevada a cabo con el apoyo de ViiV-GSK. Se trata de un esquema de tratamiento simplificado e innovador con menor toxicidad que brinda una mejor calidad de vida a las personas que viven con VIH (PVVIH).
Esta nueva opción de tratamiento, que ahora está disponible en Argentina, es el resultado de un estudio clínico iniciado en nuestro país y que fue ratificado por los estudios GEMINI. La Fundación Huésped, Helios, el Hospital Italiano de Buenos Aires, el Hospital Municipal Vicente López “Dr. Houssay” y el Instituto CAICI fueron algunas de las instituciones en las que se llevó a cabo el estudio en nuestro país.
El estudio GEMINI contó con la participación de más de 1400 personas con VIH que no habían sido previamente tratadas de Europa, las Américas, África y la región del Asia-Pacífico, y se realizó a partir de los precedentes expuestos en el Estudio PADDLE, un proyecto piloto realizado íntegramente en Argentina por el equipo de investigadores de Fundación Huésped. Asimismo, el PADDLE continuó la línea del estudio GARDEL (diseñado, organizado y dirigido por Fundación Huésped), que demostró que la bi-terapia con esquemas con lamivudina eran igual de efectivos que los de triple terapia. Sobre la base de los resultados del Estudio PADDLE, el laboratorio ViiV diseñó el GEMINI, un estudio multi-céntrico internacional que probó esta estrategia a gran escala.
Este nuevo esquema de tratamiento deja en evidencia el enorme potencial que tiene la Argentina en investigación científica clínica. Personas que viven con HIV en nuestro país van a poder acceder a un tratamiento menos tóxico e igual de eficaz que los que ya estaban disponibles, lo que va a tener un impacto positivo en su vida a largo plazo, comentó Rosana Felice, Directora Médica de GSK Argentina & Cono Sur.
Durante los últimos 15 o 20 años el estándar de tratamiento del VIH giraba alrededor de un esquema de tres drogas. Ahora que tenemos drogas más potentes el enfoque está orientado a mejorar la tolerabilidad y la conveniencia. El estudio GEMINI demostró que podemos obtener la eficacia del uso de tres drogas en un régimen de dos con la tolerabilidad e interacción de un esquema de 3 drogas, comentó Pedro Cahn, Investigador Principal del estudio y Director Científico de la Fundación Huésped.
La FDA (Administración de alimentos y medicamentos de EEUU), la Agencia Europea de Medicamentos (EMA) y ahora la ANMAT dieron su aprobación a este esquema de tratamiento. Esta combinación de antirretrovirales posee dos drogas que actúan en puntos diferentes de la replicación del VIH (integración y transcripción inversa) logran evitar que el VIH se multiplique.
ANMAT actualizó los lotes de vacunas antigripales liberados
Listado de los lotes de vacunas antigripales liberados al día 5 de abril de 2021.
| NOMBRE COMERCIAL | LABORATORIO | N° LOTE | |
|---|---|---|---|
| AFLURIA QUAD | LABORATORIOS SEQIRUS S.A. | 298762 | TETRAVALENTE |
| AFLURIA QUAD | LABORATORIOS SEQIRUS S.A. | 299447 | TETRAVALENTE |
| AFLURIA QUAD | LABORATORIOS SEQIRUS S.A. | 299448 | TETRAVALENTE |
| AFLURIA QUAD JR | LABORATORIOS SEQIRUS S.A. | 299450 | TETRAVALENTE |
| AGRIPPAL S1 | LABORATORIOS SEQIRUS S.A. | 014309 | TRIVALENTE |
| AGRIPPAL S1 | LABORATORIOS SEQIRUS S.A. | 014310 | TRIVALENTE |
| FLUXVIR | SINERGIUM BIOTECH S.A. | 014535 | TRIVALENTE |
| FLUXVIR | SINERGIUM BIOTECH S.A. | 014536 | TRIVALENTE |
| FLUXVIR | SINERGIUM BIOTECH S.A. | 014537 | TRIVALENTE |
| FLUXVIR | SINERGIUM BIOTECH S.A. | 014654 | TRIVALENTE |
| FLUXVIR | SINERGIUM BIOTECH S.A. | 014655 | TRIVALENTE |
| FLUXVIR | SINERGIUM BIOTECH S.A. | 014656 | TRIVALENTE |
| INFLUVAC TETRA | ABBOTT LABORATORIES ARGENTINA S.A. | Y08 | TETRAVALENTE |
| INFLUVAC TETRA | ABBOTT LABORATORIES ARGENTINA S.A. | Y10 | TETRAVALENTE |
| ISTIVAC 4 | SANOFI PASTEUR | V3A671V | TETRAVALENTE |
| ISTIVAC 4 | SANOFI PASTEUR | V3A672V | TETRAVALENTE |
| ISTIVAC 4 | SANOFI PASTEUR | V3A701V | TETRAVALENTE |
| ISTIVAC 4 | SANOFI PASTEUR | V3A702V | TETRAVALENTE |
| ISTIVAC 4 | SANOFI PASTEUR | V3A703V | TETRAVALENTE |
| ISTIVAC 4 | SANOFI PASTEUR | V3A704V | TETRAVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014372 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014395 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014402 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014403 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014424 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014427 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014456 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014457 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014570 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014625 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014626 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014595 | TRIVALENTE |
| VIRAFLU PEDIÁTRICA | SINERGIUM BIOTECH S.A. | 014397 | TRIVALENTE |
| VIRAFLU PEDIÁTRICA | SINERGIUM BIOTECH S.A. | 014404 | TRIVALENTE |
| VIRAFLU PEDIÁTRICA | SINERGIUM BIOTECH S.A. | 014523 | TRIVALENTE |
¿Vitamina D para tratar Covid -19?
La búsqueda de herramientas para encontrar más tratamientos contra el COVID-19 no se ha frenado desde el inicio de la pandemia. Uno de los productos que se ha postulado es la vitamina D, que ha llamado la atención de investigadores científicos de diferentes partes del mundo. Las pruebas sobre la utilidad de la vitamina D para el coronavirus aún está en debate. En la Argentina y en Inglaterra, avanzan estudios para arrojar pistas que permitan dilucidar si la vitamina D puede ser incluida en la lista de suplementos que pueden ayudar en los afectados por el coronavirus.
Además de promover una buena salud ósea, la vitamina D puede desempeñar algunas funciones para ayudar al funcionamiento de las células inmunitarias. Algunos estudios científicos encontraron el año pasado una asociación entre los bajos niveles de vitamina D y las tasas elevadas del COVID-19. Sin embargo, esos trabajos no han podido determinar que esta deficiencia en la vitamina D sea la causa real de las tasas de la enfermedad. Podría estar ocurriendo que las poblaciones que tienen mayor deficiencia de vitamina D resulten más afectadas por el coronavirus por otros motivos, como por ejemplo un menor acceso a los servicios de salud o condiciones preexistentes como la obesidad.
También hubo ensayos clínicos que han intentado determinar si la vitamina D puede ayudar a los pacientes con COVID-19. La posibilidad recibió más atención cuando el 2 de octubre pasado se conoció que el ex presidente de los Estados Unidos, Donald Trump, recibió vitamina D cuando fue diagnosticado con COVID-19. En Inglaterra, la vitamina D se recomienda para su consumo al comienzo del invierno. Pero hasta ahora, ninguna investigación ha demostrado un efecto lo suficientemente contundente como para respaldar dosis más altas para prevenir o tratar el coronavirus.
Varios estudios han demostrado una asociación entre la vitamina D y los resultados de COVID-19, pero son en gran medida observacionales. Esto significa que analizan lo que ocurre con las personas con niveles más altos y más bajos de vitamina D, pero no se controlan otros factores. Los estudios observacionales muestran que ciertos grupos son más propensos a tener deficiencias de vitamina D y a contraer Covid: las personas mayores, las personas con obesidad, y las personas con piel más oscura.
Es posible que una deficiencia en la vitamina D sea la razón por la que estos grupos tienen un mayor riesgo, o puede haber otros factores de salud y ambientales que provoquen tanto una caída de niveles de vitamina D como una mayor susceptibilidad al coronavirus.
Pero también es posible que los niveles de la vitamina D también pueden descender como consecuencia de la enfermedad y que no sean la causa.
Para aclarar cuál es el rol de la vitamina D, se esperan los resultados de varios estudios en curso. Un ensayo controlado y aleatorizado se está llevando a cabo en la Universidad Queen Mary de Londres. Otro ensayo se está realizando en Argentina con financiamiento del Ministerio de Ciencia, Tecnología e Innovación.
Según contó a Infobae el doctor Walter Manucha, investigador del Instituto de Medicina y Biología Experimental de Cuyo del Conicet en Mendoza, se está haciendo un ensayo controlado multicéntrico con vitamina D en altas dosis versus placebo para prevenir las complicaciones evolutivas de pacientes infectados por COVID-19. Se les administra un grupo de pacientes leves a moderados con la vitamina D y otro grupo solo recibe placebo.
El ensayo fue uno de los 64 elegidos por una convocatoria de la Agencia Nacional de Promoción de la Investigación, el Desarrollo Tecnológico y la Innovación, que depende del Ministerio de Ciencia. El estudio intenta comprobar si las altas dosis de vitamina D3 (colecalciferol) reduce el riesgo de mayores complicaciones en los pacientes leves y moderados. Se intenta averiguar si la elevación en forma rápida y sostenida de los niveles de vitamina D en sangre puede morigerar la situación de estos pacientes y mejorar rápidamente la respuesta del organismo frente a la infección.
Otra pista fue dada por otro estudio -aún sujeto a revisión de pares-, que fue realizado por un equipo internacional de investigadores de la Universidad de Nueva York, Instituto de Cáncer Barts Cancer, de Londres, entre otros-. Sugirió que las tasas de mortalidad por COVID-19 son menores en los países con una exposición anual al sol más insuficiente, pero con niveles medios de vitamina D más altos. Este trabajo señala que se necesitan resultados de ensayos clínicos controlados que permitan aclarar si hay relación entre el consumo de vitamina D y COVID-19
El año pasado, hubo un estudio de la Universidad de Barcelona que capturó la atención. Sugirió que la vitamina D había tenido un éxito asombroso, con una reducción del 80% de los ingresos en cuidados intensivos y una reducción del 60% de las muertes por Covid. Fue ampliamente compartido en Internet. Pero luego fue retirado por “preocupaciones sobre la descripción de la investigación”, y la revista The Lancet inició una investigación sobre ese trabajo.
Takeda: presentaciones regulatorias para vacuna del dengue
Takeda anunció que la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés) ha aceptado los paquetes de presentaciones de la empresa correspondientes a su vacuna candidata contra el dengue (TAK-003), que está en investigación para la prevención del dengue provocado por cualquiera de los serotipos del virus en personas de entre 4 y 60 años. Takeda prevé hacer presentaciones regulatorias en Argentina, Brasil, Colombia, Indonesia, Malasia, México, Singapur, Sri Lanka y Tailandia durante 2021.
"Las presentaciones regulatorias correspondientes a nuestra vacuna candidata contra el dengue, TAK-003, representan un avance importante para las personas que viven en comunidades amenazadas por la enfermedad o que viajan a lugares afectados", señaló Derek Wallace, vicepresidente y líder del Programa Global de Dengue de Takeda.
Derek sostuvo que "los brotes de dengue, que producen medio millón de hospitalizaciones por año a nivel mundial, pueden agobiar a las comunidades y gobiernos por su amplio impacto en el sistema sanitario".
"Con opciones limitadas para prevenir la enfermedad, hay una necesidad apremiante de vacunas contra el dengue disponibles a nivel mundial. Takeda se compromete a colaborar con las autoridades regulatorias y los organismos prescriptores para apoyar la evaluación de nuestras presentaciones y lograr el acceso a TAK-003", afirmó.
Takeda participa en la primera evaluación paralela de un producto medicinal de la EMA para uso en la Unión Europea (UE), y a través del procedimiento EU-M4all (anterior artículo 58) para los países fuera de la UE. Junto con la opinión científica emitida por el Comité de Medicamentos de Uso Humano (CHMP), los entes reguladores nacionales en países que participan en el procedimiento EU-M4all harán sus propias evaluaciones para determinar si se otorgan las autorizaciones de comercialización de TAK-003. Takeda también busca la aprobación de TAK-003 en países endémicos del dengue que no participan en el proceso EU-M4all.
Las presentaciones regulatorias correspondientes a TAK-003 incluyen datos sobre la eficacia y seguridad a largo plazo durante 36 meses a partir del crucial Estudio de la eficacia de la vacuna tetravalente contra el dengue (TIDES, por sus siglas en inglés) de fase 3 en curso. Takeda prevé presentar y publicar detalles de los datos recopilados durante 36 meses en una reunión científica y una revista revisada por expertos este año.
Takeda también tiene previsto hacer presentaciones regulatorias en Estados Unidos y posteriormente en otros países en Asia y Latinoamérica.
EU-M4all
EU-M4all (o Medicamentos de la UE para todos) es un procedimiento para facilitar el acceso de los pacientes a medicamentos esenciales o vacunas cuyo fin es el de prevenir o tratar enfermedades de gran interés para la salud pública. Mediante el procedimiento EU-M4all (anteriormente conocido como el procedimiento del artículo 58), la EMA, en alianza con la Organización Mundial de la Salud (OMS), puede brindar una opinión científica sobre los medicamentos y vacunas contra enfermedades que son prioritarias para la salud pública, destinados a mercados fuera de la UE.
Acerca de TAK-003
La vacuna candidata tetravalente contra el dengue (TAK-003) de Takeda se basa en un virus del dengue vivo atenuado serotipo 2, que ofrece la 'estructura' genética para los cuatro virus de la vacuna. Los datos clínicos de la fase 2 en niños y adolescentes mostraron que TAK-003 indujo respuestas inmunitarias contra los cuatro serotipos del dengue tanto en participantes seropositivos como seronegativos, que persistió durante 48 meses tras la vacunación y se observó que la vacuna era segura y bien tolerada en términos generales. El ensayo fundamental de fase 3 TIDES cumplió con su criterio de valoración principal de la eficacia general de la vacuna (EV) contra el dengue confirmado virológicamente (DCV) tras 12 meses de seguimiento y todos los criterios de valoración secundarios tras 18 meses de seguimiento para el que había una cantidad suficiente de casos de dengue, incluso la EV contra el dengue en pacientes hospitalizados y la EV en participantes seropositivos y seronegativos al inicio. La eficacia variaba según el serotipo. Los resultados demostraron que TAK-003 se toleró de manera satisfactoria en términos generales y no se han observado riesgos de seguridad importantes hasta la fecha.
Acerca del ensayo de fase 3 TIDES (DEN-301)
El ensayo TIDES de fase 3, doble ciego, aleatorizado y controlado con placebo evalúa la seguridad y la eficacia de dos dosis de TAK-003 para la prevención del dengue sintomático, de cualquier gravedad y confirmado por análisis de laboratorio, provocado por cualquiera de los cuatro serotipos de virus dengue en niños y adolescentes. El ensayo TIDES es el mayor ensayo clínico de intervención de Takeda hasta la fecha, en el que participaron más de 20.000 niños y adolescentes sanos de entre 4 y 16 años de edad que viven en zonas donde el dengue es endémico. Los participantes en el estudio fueron asignados aleatoriamente para recibir 0,5 ml de TAK-003 o placebo mediante inyección subcutánea en los días 1 y 90. El estudio consta de cinco partes. La primera parte y el análisis del criterio de valoración principal evaluó la eficacia de la vacuna (EV) y su seguridad en los 15 meses posteriores a la primera dosis (12 meses después de la segunda dosis). La segunda parte del estudio siguió durante otros seis meses para completar la evaluación de los criterios de valoración secundarios de la EV por serotipo, seroestado inicial y gravedad, incluso EV para pacientes hospitalizados por dengue. La parte 3 evalúa la EV y la seguridad a largo plazo mediante un seguimiento de los participantes durante otros dos años y medio a tres. La parte 4 evaluará la seguridad durante 13 meses tras la vacuna de refuerzo y la parte 5 evaluará la seguridad a largo plazo durante un año posterior a la finalización de la parte 4.
El ensayo se lleva a cabo en zonas de América Latina (Brasil, Colombia, Nicaragua, Panamá y República Dominicana) y Asia (Filipinas, Sri Lanka y Tailandia) donde el dengue es una enfermedad endémica, existen necesidades no satisfechas en cuanto a su prevención y en las que el dengue es una de las principales causas de enfermedad grave y muerte entre los niños. Se extrajeron muestras de sangre iniciales, de referencia, de todos los individuos participantes en el ensayo para poder evaluar la seguridad y la eficacia en función del seroestado. Takeda, junto con un Comité de supervisión de datos independiente formado por expertos, realizan un seguimiento activo de la seguridad de manera permanente.
Butanvac: la primer vacuna brasileña contra el Covid-19
Brasil está a las puertas de empezar a probar en humanos una vacuna desarrollada por el estatal Instituto Butantán. Es una noticia que podría cambiar el desarrollo de la pandemia en América Latina, una región donde el avance del Covid-19 vuelve a acelerarse en varios países. Por ese crecimiento en el número de contagios, Argentina suspendió los vuelos con Brasil, Chile y México. En otras noticias, Alemania clasificó a Francia como “zona de alto riesgo”.
La pandemia de Covid-19 sigue avanzando en todo el mundo, mientras los países tratan de acelerar sus campañas de vacunación y buscar recursos para combatirla. Por ejemplo, Brasil anunció su primera vacuna desarrollada en el país, una vacuna que tendrá como objetivo distribuirse en el sur global y en los países con más dificultades para asegurar los fármacos. Otros países siguen, mientras tanto, aumentando las restricciones para evitar que los contagios crucen más fronteras. Alemania declaró a toda Francia como zona de alto riesgo de infección de Covid-19 y Argentina suspendió sus vuelos regulares con Brasil, México y Chile.
El gobernador de Sao Paulo, Joao Doria, anunció que el Instituto Butantán, una institución pública brasileña, ha desarrollado su propia vacuna, la Butanvac. El fármaco está a la espera de la aprobación de las entidades reguladoras del país para empezar a probarse en humanos. Es un anuncio histórico para el mundo. La vacuna 100 % nacional, con pruebas prometedoras y fruto del trabajo de una institución de 120 años de su existencia, que es el mayor productor de vacunas del Hemisferio Sur, recordó Doria en una rueda de prensa desde Sao Paulo.
Joao Doria, una de las caras de la lucha contra la pandemia en Brasil y fuerte opositor del presidente Jair Bolsonaro, anunció que espera empezar la inoculación con el fármaco Butanvac en julio, una fecha ambiciosa.
El objetivo del Instituto Butantán es producir 40 millones de dosis este año a partir de mayo, con el objetivo de contribuir a la campaña de vacunación brasileña, que por ahora se desarrolla con lentitud. La Butanvac está diseñada para inmunizar contra la variante P1 del Covid-19, la variante encontrada en el estado del Amazonas que disparó una fuerte segunda ola de contagios en Brasil y que ya ha llegado a la mayoría de países del continente.
El Butantán ya ha producido 27,8 millones de dosis de la vacuna china CoronaVac, la base de la campaña de vacunación de Brasil, a través de un acuerdo con Sinovac. El director del Instituto, Dimas Covas, aseguró que el desarrollo de la nueva vacuna no interferirá con la producción del otro fármaco.
La producción de este medicamento podría suponer un cambio a corto pero sobre todo a mediano plazo en la geopolítica sanitaria que ha venido de la mano de la pandemia. Según Covas, el objetivo de la Butanvac es ofrecerla para países de renta baja y media, que es donde necesitamos combatir la pandemia. Según el director del Instituto Butantán, su vacuna podría ser una gran contribución y va a ser la diferencia en el curso de la epidemia y nos va a ayudar a combatirla en todo el mundo.
Identifican más cualidades del Ibuprofeno para tratar el Covid-19
El proyecto de investigación de la Universidad Nacional de Villa María (UNVM) se basa en una simulación computacional de una proteína de interés del virus en complejo con la molécula del Ibuprofeno. Determina que la proteasa principal (Mpro) del SARS-CoV-2 representa un blanco farmacológico atractivo para la inhibición de su replicación.
De esta manera, el trabajo demuestra que el fármaco “interacciona con éxito contra la región inhibidora de la proteasa principal del virus, con enlaces energéticamente favorables” y también que “la fuerza iónica (concentraciones de NaCl) modifica en forma significativa sus afinidades de unión”.
La investigación, publicada en la revista internacional Journal of Biomolecular Structure and Dynamics, es dirigida por Ariel Garro, quien destacó que “si bien las técnicas computacionales (estudios in silico) no reemplazan los ensayos biológicos, representan un nuevo horizonte en la ciencia porque permiten analizar y predecir el potencial farmacológico de una molécula optimizando el tiempo y los recursos”. Por otra parte, remarcó que “en este caso en particular el trabajo publicado resulta en un gran aporte a las investigaciones actuales sobre el potencial uso del ibuprofeno en el tratamiento de COVID-19”.
Cabe destacar que este fármaco ya se está probando en pacientes con el virus de la provincia de Córdoba como terapia de rescate, pero no se conoce exactamente el modo de acción a nivel molecular de este nuevo tratamiento.
“En base a eso, la investigación que hicimos fue un trabajo teórico, no experimental, y describimos un posible mecanismo de acción sobre el virus, observando que el Ibuprofeno se une a una proteína importante del virus, y al unirse podría inhibirlo”, añadió.
“Nuestros resultados de acoplamiento mostraron que ambos enantiómeros de ibuprofeno se acoplaron con éxito contra la región inhibidora de la principal proteasa del virus SARS-CoV-2, con enlaces energéticamente favorables. Ambos interactuando con residuos catalíticos, el bolsillo de unión al sustrato e interactuando con los residuos involucrados en el proceso de dimerización. Los cálculos vinculantes de energía libre utilizando MM-GBSA y MM-PBSA confirman la afinidad de estos complejos”, agregó.
Ante ello, concluyeron que, además de ser antiinflamatorio, el fármaco tiene cualidades que “ayudan a reducir los efectos nocivos de la inflamación en el huésped y puede proporcionar un resultado terapéutico beneficioso adicional”.
A partir del resultado proponen que el ibuprofeno “puede representar una potencial opción de tratamiento” al afectar directamente la replicación del virus. Sin embargo, aclararon que hay que realizar experimentos y estudios clínicos para “validar su eficacia”.
Del proyecto participan también las becarias doctorales Camila Clemente y María Freiberger, la investigadora del CIT-Villa María Soledad Ravetti y Dante Beltramo.
Dieron a conocer el tema del Día Mundial del Farmacéutico 2021
Las encuestas de confianza revelan que la desconfianza en los líderes sociales ha aumentado y la incredulidad en las fuentes de información está en un nivel récord, impulsada por la pandemia de COVID-19 y la infodemia que la rodea. En un momento de incertidumbre y cuando el escepticismo sobre las vacunas sigue siendo un obstáculo importante, la confianza del público en la farmacia es más importante que nunca.
Durante muchos años, los farmacéuticos han sido nombrados sistemáticamente entre los cinco profesionales más confiables en las encuestas nacionales. Los educadores también se encuentran constantemente entre los cinco primeros y, según una encuesta reciente, los científicos están las personas más confiables del mundo. “Farmacéuticos, educadores y científicos: esa es nuestra profesión farmacéutica”, señala el presidente de la FIP, Dominique Jordan.
La campaña del Día Mundial del Farmacéutico de este año es una oportunidad para que la farmacia muestre su agradecimiento por la confianza depositada en la profesión y aumente la conciencia de esta confianza y del papel vital de los farmacéuticos en la mejora de la salud.
“La evidencia indica una asociación significativa entre la confianza en los profesionales de la salud y los resultados de salud de los pacientes. La farmacia ha acumulado una reserva de confianza durante muchos años de cuidado, relaciones positivas, experiencia y excelente práctica, todo brindado con consistencia. Podemos hacer un buen uso de esta confianza para contrarrestar a los anti-vacunas y para continuar mejorando la salud de nuestras comunidades en general. Invito a mis colegas de todo el mundo a unirse a la campaña de este año y difundir estos importantes mensajes”, agregó Jordan.
Este año, la FIP también realizará su segunda Semana Mundial de la Farmacia (del 19 al 25 de septiembre), que celebrará la profesión farmacéutica con un programa de eventos especiales.
ANMAT recomendó el uso de la vacuna SINOPHARM en mayores de 60 años
La ministra de Salud de la Nación, Carla Vizzotti, anunció que la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) recomendó al Ministerio de Salud de la Nación autorizar el uso de emergencia de la vacuna SINOPHARM en el grupo de mayores de 60 años.
De esta forma, la vacuna provista por el Beijing Institute of Biological Products Co Ltd., podrá utilizarse en nuestro país para avanzar en la inmunización de este grupo de riesgo.
La ANMAT indicó que la seguridad analizada en el ensayo de Fase III entre el grupo de vacunados y el grupo placebo, resulta con un perfil aceptable y hasta el momento del análisis no hubo eventos adversos inesperados o graves relacionados al producto.
La inmunogenicidad correspondiente al grupo etario de mayores de 60 años presenta una cantidad de anticuerpos neutralizantes compatible con el de menores de 59 años.
El análisis interino reportó que la eficacia determinada con el ensayo clínico en el que participaron 25.730 voluntarios, es 78,89%.
La ministra comunicó la recomendación durante un encuentro con integrantes de la Comisión Nacional de Inmunizaciones (CONAIN) donde se analizan permanentemente las distintas estrategias de vacunación para fortalecer la respuesta a una segunda ola de casos de COVID-19.
Primer dispositivo que detecta el Covid-19 a través de la coagulación
La Administración de Medicamentos y Alimentos de Estados Unidos (FDA, por sus siglas en inglés) ha autorizado, para su uso de emergencia, el primer dispositivo de detección sin diagnóstico de Covid-19. Este aparato, conocido como Tiger Tech Covid Plus, es capaz de identificar ciertos biomarcadores que pueden ser indicativos de una infección por SARS-CoV-2.
Este dispositivo está ideado para que sea utilizado por personal cualificado que pueda interpretar correctamente la información que ofrece sobre biomarcadores de la coagulación sanguínea. Los expertos de la FDA afirman que su uso complementaría la toma de temperatura que se realizada en algunos centros e instituciones para detectar, sobre todo, casos de pacientes asintomáticos.
Identificar positivos para reducir la propagación Covid
El Tiger Tech Covid Plus es un brazalete que tiene sensores de luz y un procesador integrado. Este se coloca sobre el brazo izquierdo por encima del codo para obtener datos sobre el flujo sanguíneo del paciente. Una vez completada la medición, el procesador proporciona datos sobre la coagulación en sangre, un dato que serviría para ver si se hay hipercoagulación, una anomalía muy común en los pacientes Covid.
Jeff Shuren, director del Centro de Dispositivos y Salud Radiológica de la FDA, afirma que la combinación del uso de este nuevo dispositivo de detección, que puede indicar la presencia de ciertos biomarcadores, con controles de temperatura podría ayudar a identificar a las personas que pueden estar infectadas con el virus, ayudando así a reducir la propagación de Covid-19 en una amplia variedad de entornos públicos , incluidas las instalaciones sanitarias, las escuelas, los lugares de trabajo, los parques temáticos, los estadios y los aeropuertos .
Alto porcentaje de eficacia
El estudio sobre este dispositivo se llevó a cabo entornos hospitalarios y centros escolares. En ambos sitios dio resultados muy similares, demostrando que este aparato tenía un porcentaje de concordancia positiva (proporción de individuos positivos de Covid-19 identificados correctamente por el dispositivo) del 98,6 por ciento y un porcentaje de concordancia negativo (proporción de los individuos negativos Covid-19 identificados correctamente por el dispositivo) del 94,5 por ciento.
Aun así, desde la FDA señalan que este monitor no es un dispositivo de diagnóstico y no debe usarse para diagnosticar o excluir una infección por SARS-CoV-2. El dispositivo está diseñado para su uso en personas sin fiebre y como complemento en la detección de la enfermedad.
Lo más visto
- Covishield, la vacuna que India lanzó con Oxford-AstraZeneca
- El gobierno establece los requisitos para la producción de cannabis medicinal
- Anmat aprobó en el país la primera vacuna que protege contra el dengue
- Comunicación de Novo Nordisk: Diferencias en la indicación de Victoza® y Saxenda®
- Ibupirac declarado apto para celíacos